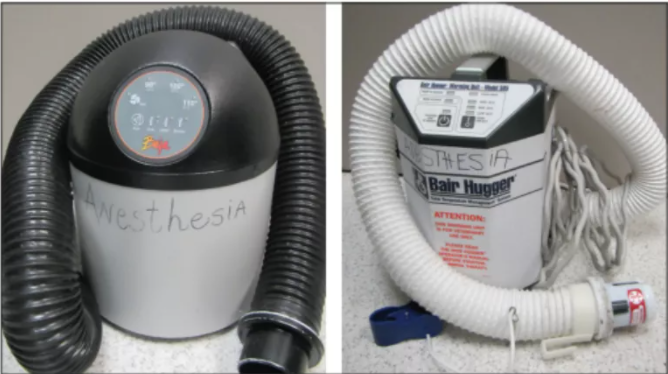
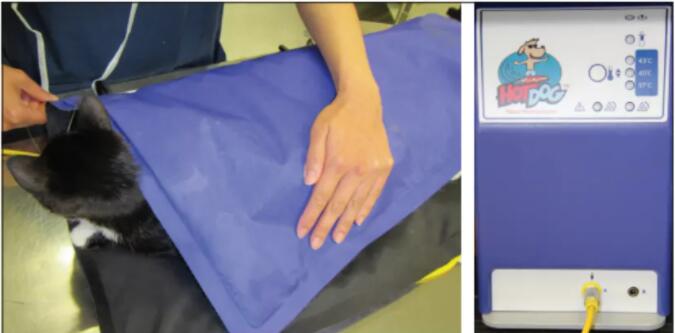
麻醉可导致体温异常,从而导致不利影响。低体温是迄今为止最常见的麻醉引发的体温异常,但体温过高也可能发生。
低体温 麻醉病人会很快出现体温过低,原因是多方面的。这些因素包括: 全身麻醉药物对下丘脑体温调节活动的直接抑制 老年动物、新生儿动物或患有某些疾病(如甲状腺功能减退)的动物的体温调节功能受损疾病; 麻醉药物引起的血管扩张导致温血从身体核心重新分布到皮肤,因此热量被释放; 麻醉引起的肌肉松弛(肌肉张力和运动有助于维持正常体温); 外科擦洗液在体表蒸发; 核心体温与环境温度通过开放体腔达到平衡; 麻醉持续时间(时间更长=更冷); 以及肺泡的大块表面积收到寒冷的麻醉气体。 小型动物尤其容易发生低温,因为相对于体重它们的体表面积很大,这意味着它们散热的表面更大。它们也可能处于非复吸系统,这意味着大量的冷空气被输送到肺部。 所有麻醉患者应监测核心体温(使用直肠或食管温度计)! 而且应该在苏醒期间重新检查体温,因为体温在上升前经常会下降! 虽然人们一度认为保持手术室低温对动物有好处,由于寒冷环境中细菌生长会减少,但我们现在知道寒冷的手术室=寒冷的病人,而体温过低不是好事情。 事实上,体温过低会导致各种并发症,其中一些会让动物发生不良反应的风险更高(表6-6)。 我们通常会注意到的并发症是苏醒时间延长。其他并发症包括凝血功能障碍、组织缺氧、酸中毒、心肌电传导异常和心肌缺血(Clarke Price 2015;Noble 2006)。 具有讽刺意味的是,体温过低动物的感染率更高(即使手术室的细菌数量更低),因为低温会损害免疫系统。体温过低也会导致大脑保护作用,减少麻醉需求。 但是,麻醉需求减少并不总是被人们识别到,而且麻醉剂量并没有改变,导致麻醉药物剂量过大。 虽然苏醒时的颤抖可能会使体温升高,但剧烈颤抖与相关的肌肉运动会导致动物不适和耗氧量增加。事实上在人医中,预防术后颤抖是一项重要任务,这也是兽医最关心的问题。 动物在麻醉期间通常会很冷。在低体温时,麻醉气体量应该减少,但这通常被忽视。 表6-6低体温的副作用 •麻醉后苏醒时间延长。 •代谢过程和酶活性被改变导致药物代谢受损(加上苏醒时间延长和药物清除效率降低导致药物剂量相对过高)。 •由于中枢神经系统功能障碍,麻醉剂需求减少(加上苏醒时间延长,可能导致麻醉剂相对过量)。 •免疫系统抑制(增加感染率并影响愈合)。 •与凝血连锁反应相关的酶活性降低和血小板功能受损,导致凝血功能障碍(可能导致大量出血)。 •血液粘度增加和血管内血液淤滞(导致血流不良,器官灌注降低)。 •心脏收缩力下降、低血压和心律失常。 •心率降低可能导致低血压,并且通常抗胆碱药治疗无效(即心率不会增加)。 •颤抖导致耗氧量增加。 •呼吸障碍(供氧减少、呼吸性酸中毒)。 •血管收缩(组织供氧减少)。 •发病率和可能死亡率增加。 表6-7低体温和低题温并发症的预防与治疗: •监测核心温度-食管温度探头或直肠温度计。 •监控环境温度(诱导麻醉、手术阶段和苏醒阶段),并尽可能使这些区域保持温暖。 •使用主动加热装置和技术,以最大限度地减少热量损失; •强制暖风机; •热水垫(不如热空气毯好); •专用电热毯(HotDog®),但不是普通电热垫; •加热手术台; •液体加温器; •温暖和湿润的呼吸导管; •爪子套上袜子、乳胶手套或羊毛织物; •不需要手术的身体部位用塑料膜或气泡膜包裹起来术中; •手术前和手术后的保温毯; •用于腹腔或伤口的温热灌洗液体。 •减少麻醉时间。 •补充氧气以满足代谢需求(颤抖)。 •监测苏醒期的复发性体温过低-这非常常见! •如果体温严重过低,考虑: •经直肠给予10 ml/kg温热等渗液体; •用温水冲洗膀胱。 保持体温的方法 犬猫正常体温为37.8°C-39.2℃。 体温应尽可能保持在正常水平(表6-7)。 体温低于36.7°C会导致不良后果。 确保动物在诱导麻醉前处于温暖状态,因为术前低体温预示术中也会低体温。 预防低体温比治疗低体温更有效,因此应采取措施,使动物在诱导麻醉开始时保持体温。体温下降的最快阶段发生在麻醉的第一个小时(Clarke Price 2015)。 强制空气加热器(图6-7)比循环水毯更有效,强制空气和循环水毯比普通的电热垫都要安全,电热垫很可能灼伤动物,不应用于麻醉动物。 当然也有例外,高度绝缘的HotDog®加热器(图6-8),其温度在达到会灼伤动物的温度之前会自动关机。保持环境温度温暖。这可以加热整个手术室,或者保持动物附近区域温暖,如使用温暖毛巾和毯子,毯子下可放上温暖设备(如米袋和水瓶),但不要直接接触动物皮肤。确保动物术后苏醒也有温暖房间或笼子。 手术擦洗液不要使用过多——仅擦洗手术部位——不要用湿液体擦洗整个身体。输液加温器、爪子套上袜子,任何有助于保持体温的方法都可以使用。 动物一旦麻醉,体温就开始下降。因此,应该同时开始预防性保温措施。如果体温过低的动物已计划麻醉时,应在诱导麻醉前开始保温。 图6-7 Baha Breeze(左)或Bair Hugger(右)这样的强制空气加热器是最有效的动物保温设备。两张照片中导管末端可以连接到特制毯子,也可以放在普通毯子下面。 图6-8高度绝缘的 Hot Dog 加热器(左边是猫身上的实际毯子;右边是加热装置),机器在达到会灼伤动物的温度前会自动断开。动物和加热毯之间可放一条毛巾以防止烧伤。 有研究表明,单独使用这些方法可能并不有效,但是将各种措施结合起来一定是有帮助的! 确保在动物和加热垫或暖水瓶之间放置毛巾。 动物如直接接触这些加热产品都可能导致被烧伤。 热风毯最不可能引起热烧伤。 重点! 不要给麻醉动物使用普通电热垫。它们很不安全。 尽量减少麻醉时间。麻醉持续时间是导致体温过低的主要因素。 体温过高 体温过高>39.4℃在麻醉动物中并不常见,但当发生时,动物可能需要积极降温(表6-8)。温度<40°C可能是“自限性”(指无需治疗,温度将自行下降),但应立即移除任何加热装置。如果体温40°C,应采取主动降温措施。如果温度>40.6至41.1℃,积极治疗。主动降温包括向动物吹风的风扇,大型浅表静脉(颈静脉和腹股沟静脉)部位放置冷水或冰袋,IV输液冷液体和衬垫喷洒酒精(仅限狗)。 当动物体温降低时,密切监测体温。不要使它们低体温。当身体温度达到39.7°C时,停止降温,以免矫枉过正导致体温过低。 体温过高的原因 •天气温暖,尤其是诊所室温也比较温暖或动物来到医院时体温轻度过高; •皮毛厚重、体型庞大的狗(更容易过热,可能与品种或遗传有关); •兴奋或应激; •过度使用取暖设备; •猫对纯mu阿片类药物的反应; •败血症、内毒素血症、病毒血症、菌血症(全身感染); •发热性输血反应; •低流量麻醉(不常用)期间的产热; •恶性高热(由罕见基因突变引起)。 表6-8体温过高的治疗 •监测核心温度-食管温度探头或直肠温度计。 •体温>40℃时积极降温;当温度降至39.7°C时停止降温: •移除任何加热装置。 •取下毯子。 •用风扇向动物送去冷风。 •使用冷却的静脉输液。 •用冷水(不是冰水)喷洒动物,但不要把动物浸入水中,除非动物完全清醒,可以吞咽(如果动物没有完全清醒,会将水吸入肺部)。 •如果体温过高>40.6℃,在大血管(例如,颈静脉、股静脉)接近的体表放置冰块——但请记住,冰会让动物不舒服,所以要逐步一点点使用。也不要在动物全身放冰块或冰水——冰引起的血管收缩可以降低热量消耗,因此动物体温不会降低。冰块也可能引起颤抖,而这会让肌肉活动增加而产生热量。 •将酒精涂抹在狗的脚垫、腹股沟和前腿下方,以达到蒸发散热(这对猫不是一个好方法——它们会舔酒精,这可能导致酒精中毒)。 •猫可以使用mu阿片类激动剂的逆转药物(如二氢吗啡酮);使用布托啡诺或丁丙诺非逆转不良反应,但并非所有镇痛作用都能被逆转。 •如果动物患有真正的恶性高热,唯一的治疗方法(尽管不是总是有效)是丹曲洛林(静脉注射2.5至5 mg/kg)始终有效,但大多数诊所不太可能有这种药。幸运的是,真正的恶性热疗是一种非常罕见的遗传病,发病率很小。 重视基础护理 考虑动物的总体舒适度应该在术前、术中和术后。动物应保持温暖、干燥,并控制疼痛。术中不要忘记动物姿势异常(如腿外伸和被绳子绑在桌子),冰冷、坚硬手术台缺少衬垫可能导致肌肉和关节疼痛,尤其是患有疼痛骨关节炎的老年动物。保定尽量轻柔,并确保桌子有一些衬垫。 术后,确保动物可以排尿。我们经常把动物排尿需要与术后烦躁甚至疼痛互相混淆。如果动物术后躁动不安,并且你已经解决了疼痛问题,请带狗外出,让它排空膀胱!也考虑特定物种的需求,比如把猫安置在远离狗叫的地方,并提供盒子,可以让猫躲起来同时从麻醉中恢复(但要在盒子上开个洞,这样你就可以看着动物!)。 无论我们在兽医学的复杂技术方面有多么出色,如果不解决基本护理问题,就无法满足动物的需求。 总结 麻醉引起的变化可能导致并发症,如果这些变化没有通过支持护理技术降低不良影响,比如关注麻醉深度、提供镇痛和心血管系统、呼吸和体温调节系统的相应支持。所有麻醉动物应接受吸氧。 大多数动物都强烈推荐静脉输液,以及生病、创伤、出血、老年或任何其他可能导致低血容量的动物也应按需补液。维持正常体温常常没有被当成麻醉护理的关键部分,但体温过低会导致许多并发症,并使苏醒非常缓慢,这可能很危险。 最后,基本护理是一种重要的支持机制,不容忽视。 参考文献: Clark-Price S. Inadvertent Perianesthetic Hypothermia in Small Animal Patients. Vet Clin North Am Small Anim Pract. 2015;45(5):983-94. Davis H, Jensen T, Johnson A, Knowles P, Meyer R, Rucinsky R, Shafford H; 2013 AAHA/AAFP fluid therapy guidelines for dogs and cats. American Association of Feline Practitioners; American Animal Hospital Association. J Am Anim Hosp Assoc. 2013 May-Jun; 49(3):149-59. McNally EM, Robertson SA, Pablo LS. Comparison of time to desaturation between preoxygenated and nonpreoxygenated dogs following sedation with acepromazine maleate and morphine and induction of anesthesia with propofol. Am J Vet Res. 2009 Nov; 70 (11):1333-8. Noble KA. Chill can kill. J Perianesth Nurs. 2006 Jun; 21(3):204-7.