前言
2021年1月初,Sutro Biopharma宣布,根据该公司与德国默克公开了M1231 ADC药物的临床试验信息。M1231是SUTRO开发的一个EGFR/MUC1特异性双抗ADC,2014年与德国默克达成合作。
2021年4月初,杭州多禧生物科技有限公司申报的“注射用重组人源化抗MUC1单抗-Tub201偶联剂”临床试验申请获得受理(受理号:CXSL2100114)。这是国内首款MUC1靶向ADC药物。

紧接着,4月16日,齐鲁制药获得韩国生物科技公司Peptron一款在研、靶向MUC1的抗体偶联药物(PAb001-ADC),同时获得这款在全球范围内的独家授权。
MUC1在放射疗法中也具有应用前景。比如靶向MUC1 可作为载体利用癌细胞与正常细胞之间的差异,将放射性核素输送至肿瘤,以进行诊断性成像和放射治疗。最新的研究发表在今年4月6号的《Molecular Pharmaceutics》杂志上。
实际上在CAR-T第四代疗法开发中,MUC1也成为很重要的靶点。去年1月,中国研究者在《Cancer Medicine》杂志发表了一项靶向MUC1的CAR-T疗法对HNSCC的治疗效果。数据显示,这种新型CAR-T细胞疗法能够在体内诱导HNSCC的肿瘤降解。往CAR-T应用实体瘤的方向上又迈出了一步。
在研究人类黏蛋白MUC1的过程中,对这种分子的态度一次又一次地改变。过程充满了希望和失望(故事大家可自行检索)。人们已经研究了它40年,作为肿瘤标记物也有30年的时间。从它的名字就能看出它很有故事。上皮膜抗原(EMA),PAS-O,MAM-6,乳腺血清抗原(MSA),花生-凝集素结合尿液黏蛋白(PUM),唾液唾液酸MAM-6,DF3抗原,H23抗原,Cal,非穿透性糖蛋白(NPGP),NCRC11抗原,多态性上皮黏蛋白(PEM),这些都是它的名字。最初,MUC1的功能列表上仅限于保护和润滑上皮。随着研究越来越充分,迄今为止,人们认为它在细胞信号传导以及从恶性细胞转化到肿瘤扩散的肿瘤发生的所有阶段均起着重要作用。考虑到现在开发的现状和进展,MUC1成为潜力治疗肿瘤的可能性不言而喻,因此本文总结一下,以供参考!
背景介绍
01
MUC家族
粘蛋白(Mucins)是有体内多种上皮细胞分泌的大分子量糖蛋白。它是黏膜表面粘液凝胶层的组成成分,可作为器官和组织防御屏障的一部分,起着重要的保护作用。人类MUC基因家族编码20多种蛋白质。根据其结构的不同可分为分泌型和膜结合型。分泌型的MUC适于交联以允许形成在分泌物中发现的扩展粘蛋白网络粘液凝胶。膜结合型的粘蛋白具有膜特异性结构域,从而使它们具有多种功能生物学功能是糖萼(多糖蛋白复合物)的一部分。所有粘蛋白都是高度O-连接糖基化的,这是组织特异性的并与这些位置的特定生物学功能相关联。粘蛋白生物学是动态的,其过程降解和周转与生物合成很好地结合在一起,以维持对粘膜的持续保护对抗所有外部侵略力量。粘蛋白与微生物区系的相互作用在正常功能中起重要作用。 粘蛋白在多种疾病中都有修饰,这可能是由于粘蛋白肽或糖基化。

引自:Mucins: A biologically relevant glycan barrier in mucosal protection
02
MUC1的结构与功能
MUC1是一种高度糖基化的跨膜蛋白,是一种I型跨膜蛋白,具有高度糖基化的胞外结构域,从细胞表面延伸200-500纳米。全长分为胞外区(ED,N端)、跨膜区和胞内区(CT,C端)。MUC1区由脯氨酸,苏氨酸和富含丝氨酸的(PTS)域和SEA域组成。PTS域,也叫可变数目串联重复序列(VNTR)区,由高度多态的外显子编码,该外显子编码多个20–21个氨基酸序列重复序列MUC1的胞内区(CT)是高度保守的。 该区域具有七个酪氨酸残基,其中四个(ZAP-70, PKC-γ, GSK-3β, and c-Src位点)可以被激酶磷酸化并启动信号转导级联反应。
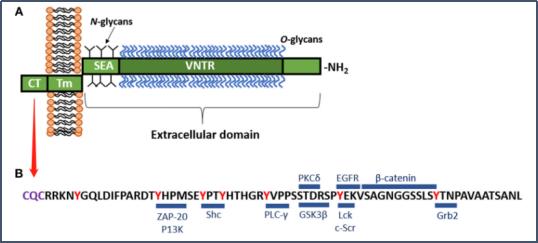
引自:The Role of the Cell Surface Mucin MUC1 as a Barrier to Infection and Regulator of Inflammation
由于MUC1是一种糖蛋白,其胞外结构域具有广泛的O-连接糖基化。粘蛋白排列在肺,胃,肠,眼睛和其他一些器官的上皮细胞的顶端表面。粘蛋白通过病原体与胞外域的寡糖结合而保护人体免受感染,从而阻止病原体到达细胞表面。
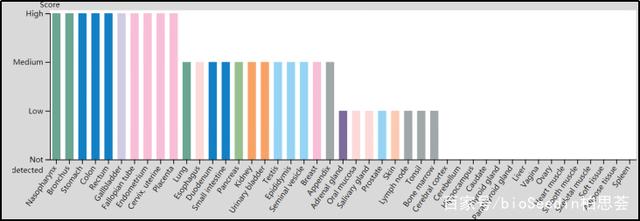
来源: https://www.proteinatlas.org/ENSG00000185499-MUC1/tissue
03
MUC1与肿瘤
MUC1的过表达通常与结肠癌,乳腺癌,卵巢癌,肺癌和胰腺癌有关。MUC1被证明存在于各种腺癌中。MUC1的表达跟肿瘤的转移和复发也是有相关性的。比如,在一项原发性肝癌的病人治疗研究中,MUC1高表达的病人比例高达68%。同时手术后复发的比例也是最高,跟MUC1表达强度呈正相关。另外,MUC1在一些血液恶性肿瘤的也是过度表达。
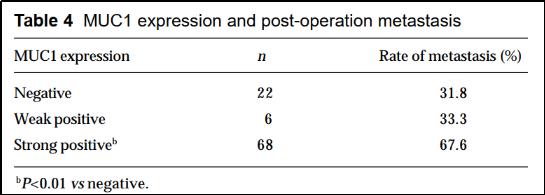
引自: Expression of MUC1 and its significance in hepatocellular and cholangiocarcinoma tissue
肿瘤组织和正常组织的MUC1不仅在表达量上有差异,肿瘤与正常组织的MUC1糖基化也存在差异。这个也是能开发区分肿瘤特异性的药物基础。
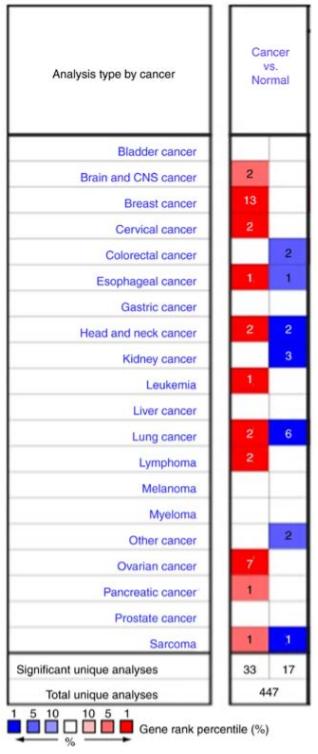
引自:Overexpression of MUC1 predicts poor prognosis in patients with breast cancer
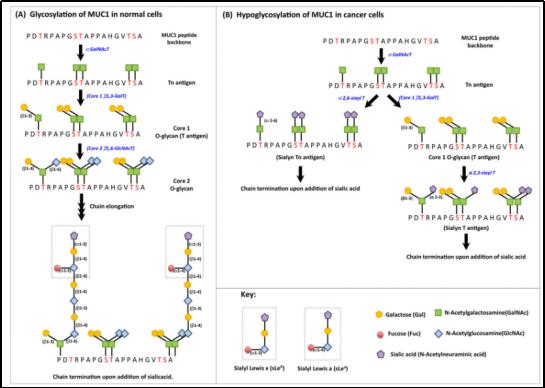
引自:MUC1: a multifaceted oncoprotein with a key role in cancer Progression
从细胞水平上看,上皮细胞或肿瘤细胞极性丧失也造成很大的影响。MUC1和生长因子是分别局限于正常上皮细胞的顶表面和基底外侧表面。然而,肿瘤细胞失去了顶点突触极性,而低糖基化的MUC1是在肿瘤细胞的整个表面过度表达,通常靠近生长因子及其受体。从而改变肿瘤基因的表达。比如,文章发现MUC1能够通过增加细胞因子(CTGF、PDGF-A/B)的分泌活化MAPK--PI3K/Akt通路促进肿瘤细胞的增殖。本身糖基化的差异造成了肿瘤细胞粘附力的降低,为肿瘤转移提供了基础。这些都是MUC1分子在正常组织和肿瘤组织分子层面的差异造成的结果。但这种差异同样提供了肿瘤中MUC1特有的表位,为治疗提供了可能性。
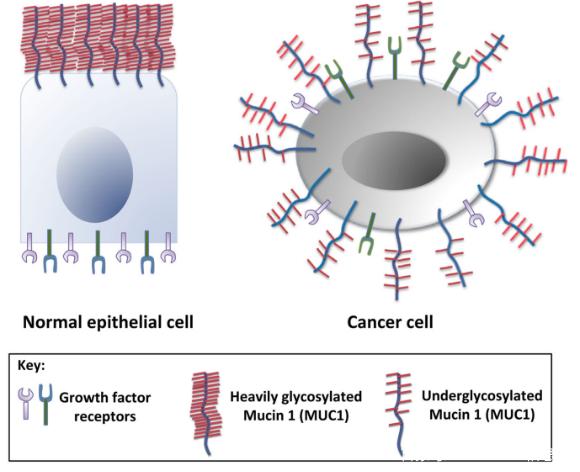
引自:MUC1: a multifaceted oncoprotein with a key role in cancer Progression
早期开发靶向治疗药物的时候都是把MUC1的抗体作为载体构建ADC来进行开发的。
04
MUC1与免疫
感染相关的癌症占所有恶性肿瘤的20%。感染期间,微生物入侵与上皮细胞内的宿主Mucins相互作用并引发炎症。MUC1几乎存在于所有上皮细胞的表面,并且已知与入侵的微生物相互作用。对不同的微生物和细胞类型,这种相互作用可以引发促炎或抗炎反应。已经形成的肿瘤中,大量MUC1可以抑制NK细胞对肿瘤细胞的杀伤作用,此外MUC1 高表达还可以抑制CTL的增殖, 甚至可以诱导CTL凋亡。
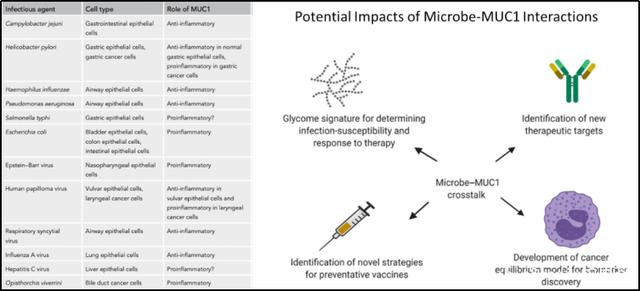
引自:Microbe–MUC1 Crosstalk in Cancer-Associated Infections
疫苗接种可以为宿主提供长期的保护作用,且几乎没有副作用,是治疗癌症的重要方法之一。肿瘤相关抗原粘蛋白-1(MUC1)在癌细胞表面的表达较正常细胞表面高100多倍。理论上应该是一个非常好的疫苗抗原。但在在人体临床试验中,结果并没有临床前的效果好。疫苗产生的抗体大多不能与肿瘤细胞很好地结合,无法有效保护机体杀灭肿瘤。
同样处境的还有肿瘤的靶向治疗,当发现肿瘤病人的预后表现跟TIL有相关性的时候,研究人员立马想到MUC1跟免疫之间的关系。之前在小鼠模型上MUC1的疫苗并没有能引起T细胞的反应,但是如果同时加上T细胞方法刺激联合疫苗之后,抗肿瘤效果就出来了。随着研究的深入,慢慢发现杀伤肿瘤主要还是靠CD8+T细胞。而CD4+T或佐剂能够有效的活化产生CD8+T细胞。另一方面,通过对免疫抑制因素的限制,比如对TGF-β, IL-10,IL-13,CD4+CD25+ Treg细胞及共刺激分子如CTLA-4,也证明了免疫疗法联用的有效性。实际上,这些研究已经将MUC1和免疫微环境联系在了一起。
05
开发现状
目前市场上对MUC1的开发主要有这几类:抗体类治疗、ADC药物、偶联放疗药物、CAR-T方向、疫苗等这么几类。根据www.clinicaltrials.gov 网站的数据,目前关于MUC1的临床实验记录总共有320多条,目前因为各种原因未完成的近1/3。使用MUC1抗体和抗体衍生的免疫疗法进行的多项试验未能转化为临床。
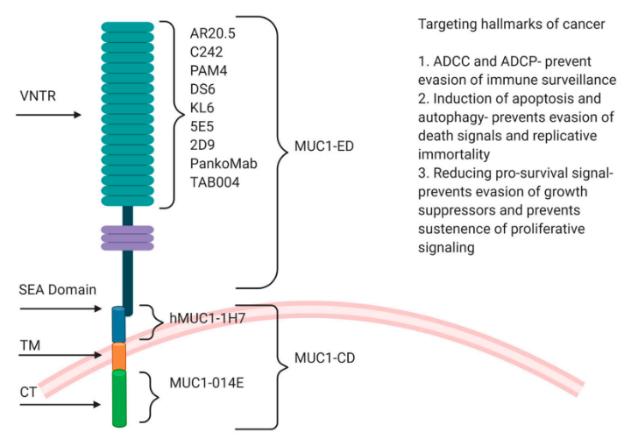
引自:Potential of Anti-MUC1 Antibodies as a Targeted Therapy for Gastrointestinal Cancers
抗体无效可能有多种原因。到目前为止,已开发出许多针对MUC1α链(MUC1-ED)的高度免疫原性VNTR区的抗MUC1抗体。在SEA结构域切割后,MUC1-N通常从细胞表面脱落并释放到外周血中。脱落的α亚基(MUC1-N)螯合抗MUC1的VNTR抗体,阻止它们与表面MUC1结合。为了克服这个问题,可以将针对MUC1-CD的抗体用作更有效的策略。MUC1-N的脱落会增加各种癌症患者血清中的水平,因此降低了肿瘤细胞上MUC1抗体的特异性和有效结合。
还有一个原因,VNTR区非糖肽部分的抗体未能产生针对tMUC1的有效细胞或体液免疫反应。MUC1肽的抗体也不能有效识别表达MUC1的肿瘤细胞。比如,针对具有简单T抗原(T,Galβ1-3GalNAc),唾液酸Tn(NeuAcα2-6GalNAc)和Tn(GalNAc)的缩短的糖肽结构具有更强的免疫原性,增强了抗肿瘤的反应。这是由于Tn和STn聚糖在表达MUC1的癌细胞上而不是在正常上皮细胞上的特定存在而发生的,并且VNTR域的封闭区域暴露于抗体的识别之下,从而产生了肿瘤特异性识别位点。这说明还是要找到区分肿瘤细胞与正常组织表达的MUC1拥有差异的地方。
引自:Chemoenzymatically synthesized multimeric Tn/STn MUC1 glycopeptides elicit
cancer-specific anti-MUC1 antibody responses and override tolerance
最后,治疗抗体具有什么特点也是差异的一个原因。某些MUC1抗体显示出ADCC和ADCP,另一些则阻止抗凋亡机制从而诱导细胞死亡,还有一些抗体降低了存活基因的表达。Gatipotuzumab是由Glycotope的GlycoExpress平台开发的一种糖基优化抗体,与未糖基化的生物治疗药物相比,它通过ADCC,肿瘤细胞吞噬作用和凋亡诱导等机制显着改善了治疗结果。如果针对肿瘤特异性MUC1的抗体带有增强的ADCC活性,被证明是有效的免疫治疗策略。比如5E5,由于对tMUC1的高度特异性和诱导ADCC的能力。另外也可以利用内吞性质与有效药物偶联以靶向特定类型的肿瘤细胞。例如,作为STAT-3抑制剂的Napabucasin正在PDA的III期临床试验中,但由于没看到好的结果而被中止。但是,已经显示出高MUC1 PDA细胞对Napabucasin更敏感。抗MUC1抗体如果欧联STAT-3抑制剂可能是消除高MUC1肿瘤的有前途的策略。因此ADC是一个非常重要的开发领域。
结语
随着对MUC1的研究和积累越来越多,尤其是对MUC1分子和机制的了解以及正常组织和肿瘤组织中MUC1的差异,针对MUC1的开发基本目前的趋势主要放在了抗体类、ADC药物、偶联放疗药物、CAR-T方向、疫苗这几类应用方向上。
综合来看,目前对MUC1作为靶点的药物开发仍然处在早期。tMUC1的结构特异性以及运输有效性、适用范围是单用药的限制因素。如果这些有突破,可能肿瘤疫苗的开发会更进一步;而联用,尤其适合免疫疗法的联合使用想要达到提高疗效的目的还需要进一步的找到机制上的可靠支持。比如,新开展的带有抗PD-1,抗MUC1和抗CD3的双特异性和三特异性抗体临床试验是正在试验中;也有抗MUC1跟抗PD-L1、EGFR、CD16a等形成的双抗在临床前研发中。相对来说ADC的开发速度会更快一些。目前临床新开展的试验也能说明这个问题。MUC1治疗时代是否已经开启需要时间的检验,最起码现在看起来还是前景还是令人期待。