前列腺癌是欧美国家最常见的恶性肿瘤之一,位居欧美男性肿瘤发病率的第二位。在美国,前列腺癌的发病率占所有恶性肿瘤的第一位,死亡率仅次于肺癌。中国属于前列腺癌发病率较低的国家,根据2020年底赫捷院士发布的癌症数据,我国男性前列腺癌发病率达6.47/10万。但随着我国经济水平的提高、居民生活方式的改变和寿命的延长,我国男性前列腺癌的发病率正不断上升。
针对晚期前列腺癌的治疗,雄激素剥夺治疗(ADT)依然是一线疗法,包括手术去势(双侧睾丸切除术)或药物去势(LHRH激动剂),但晚期前列腺癌常发生转移或去势抵抗,许多患者甚至在接受ADT的第一年便发展为去势抵抗前列腺癌(CRPC,Castrate-Resistant Prostate Cancer)。针对CRPC,雄激素受体阻断剂(AR)如阿比特龙、恩杂鲁胺在临床已广泛运用,但缓解率有限。目前,靶向PSMA的免疫疗法已进入临床,未来有望为晚期去势抵抗前列腺癌患者提供新的用药选择。
前列腺特异性膜抗原(PSMA,Prostate Specific Membrane Antigen)是前列腺细胞一类特异性的肿瘤标志物,含有750个氨基酸,其中胞外段707个,跨膜段24个,胞内段19个。研究发现,PSMA在正常前列腺组织中低表达,但在大多数前列腺癌组织中高表达,并随着肿瘤进展表达增高,尤其是在ADT治疗后的雄激素非依赖性前列腺癌细胞中几乎100%高表达。此外,PSMA还在许多非前列腺实体恶性肿瘤的血管内皮细胞上表达上调,包括乳腺癌、卵巢癌、非小细胞肺癌、甲状腺癌等。目前,诸多企业开展了针对PSMA靶点药物的研发,双抗、放射配体疗法、CAR-T细胞疗法等相继登场,群雄逐鹿。
PMSA双抗
(1)AMG160由安进研发,国内权益归属百济神州。AMG160的设计基于HLE-BiTE平台,Fc区域的引入延长了药物的半衰期。AMG160通过与肿瘤细胞上的PSMA和T细胞上的CD3结合,招募T细胞定向杀伤PSMA阳性的肿瘤细胞。
2020年ESMO年会公布了AMG160四线治疗mCRPC的Ⅰ期研究,结果显示ORR达5.55%(1/18),SD达27.78%(5/18),DCR达33.33%。安全性方面,3级及以上CRS发生率达31.3%(10/32),其他3级不良事件包括血压过低(12.5%)、疲劳(9.4%)、呕吐(3.1%)、腹泻(6.3%)等。此外,接近20%的患者出现抗药抗体(ADA)。笔者认为,目前AMG160单药治疗mCRPC效果难言乐观,后续安进公司在提升药物疗效的同时还需破解安全性问题。除了AMG160单药疗法外,安进公司正在探索AMG160联用帕博利珠单抗治疗mCRPC的研究。
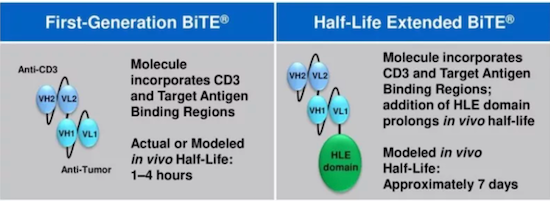
(2)APVO414(MOR209/ES414)是由Aptevo Therapeutics研发的基于ADAPTIR平台一款靶向CD3×PSMA的双抗药物,用于去势抵抗前列腺癌的治疗。APVO414拥有Fc区域,半衰期较长,且消除了ADCC和CDC作用。
ADAPTI平台
数据来源:Aptevo
2016年AACR公布了APVO414的临床前实验结果,APVP414在低浓度时即有较高的T细胞激活和介导肿瘤细胞裂解的作用。小鼠试验分析血浆半衰期为4d,可显著抑制小鼠体内肿瘤生长。此外,持续给药的效果优于每周给药,原因在于每周给药会产生更多的抗药抗体(ADA),削弱治疗效果。
然而,APVO414终是遭遇了临床失败。2018年,由于免疫原性的问题,公司终止了APVO414的研发。
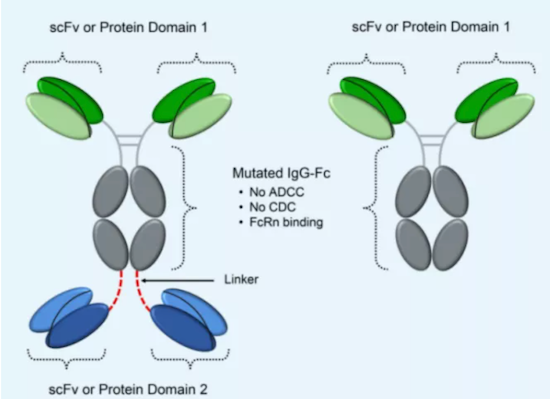
但Aptevo Therapeutics并未中止对PSMA这一靶点的探索,公司基于ADAPTIR-FLEXTM平台设计了APVO442,通过使用与CD3弱结合力的scFv域,有望降低与外周T细胞的结合,减少细胞因子的释放。目前APVO442处于临床前阶段。
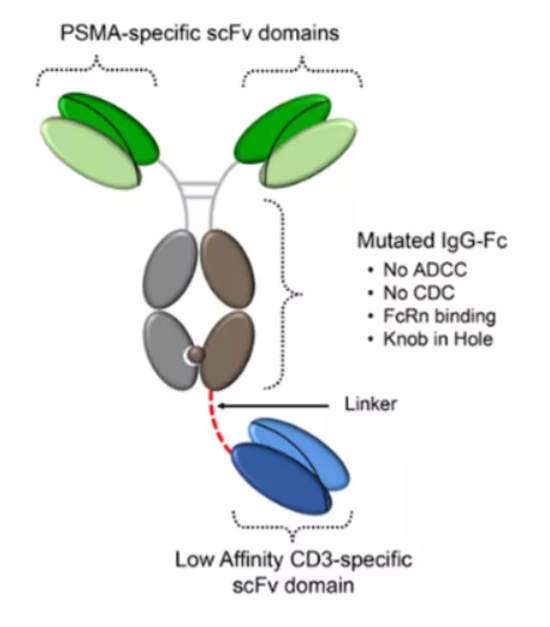
ADAPTI-FLEXTM平台
数据来源:Aptevo
(3)HPN424是由Harpoon Therapeutics研发的一款三特异性抗体,基于TriTac平台研发。TriTac(Tri-Specific T Cell-Activating Construct)平台除了靶向T细胞表面CD3和肿瘤细胞表面特异性抗原外,包含一段人血清白蛋白以提升抗体半衰期。由于不含Fc区域,TriTac的分子量仅为单抗的1/3,对实体瘤具有潜在更强的穿透能力。
在2021年ASCO上,Harpoon Therapeutics公布了HPN424的1/2a期试验结果。截至2021年4月23日,试验纳入89名先前至少接受过5线治疗的mCRPC患者,试验结果显示,20%(15/74)的患者接受了至少6个月的治疗,其中一名患者出现部分缓解(6.67%,1/15)。未达到MTD,3级CRS发生率达4%,3级AST和ALT升高(21%和16%)。
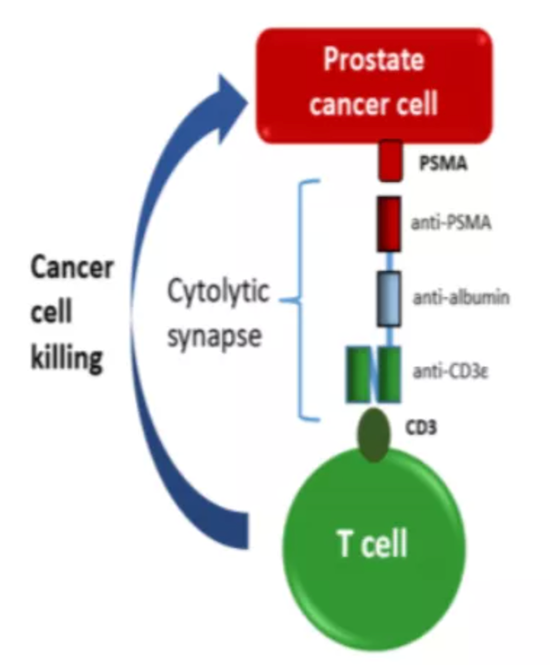
HPN424
数据来源:Harpoon Therapeutics
放射配体疗法(RLT)
由于前列腺癌是对放疗敏感的肿瘤,前列腺癌的放射免疫治疗成为研究的重点,目前常见的核素包括177Lu、90Y等。由于作用机制的独特性,因此,与传统抗癌疗法相比,放射配体疗法的显著优势在于几乎所有肿瘤的常规耐药机制对其不产生影响。
177Lu-PSMA-617是一款由诺华研发的PSMA靶向性放射配体疗法(RLT,Radioligand therapy),用于治疗mCRPC。该药是一种结合了小分子靶向性化合物(PSMA-617)和治疗性放射性同位素(177Lu)的精准癌症治疗方法。在注入血液后,177Lu-PSMA-617与表达PSMA的前列腺癌细胞结合,一旦结合,来自放射性同位素的辐射会损伤肿瘤细胞,破坏其复制能力并触发细胞死亡。
2021年ASCO,诺华公布了177Lu-PSMA-617的Ⅲ期临床研究数据。自2018年7月至2019年10月,试验入组831名患者,以2:1的比例纳入177Lu-PSMA-617+SOC组(n=551)和SOC组(n=280)。结果显示,试验组的PFS和OS显著提升,试验组和对照组PFS为8.7 vs 3.4m,OS为15.3 vs11.3m,ORR为29.8% vs 1.7%,DCR为89% vs66.7%。不良事件方面,试验组的不良事件发生率略高于对照组,严重不良事件风险率为52.7% vs38.0%。
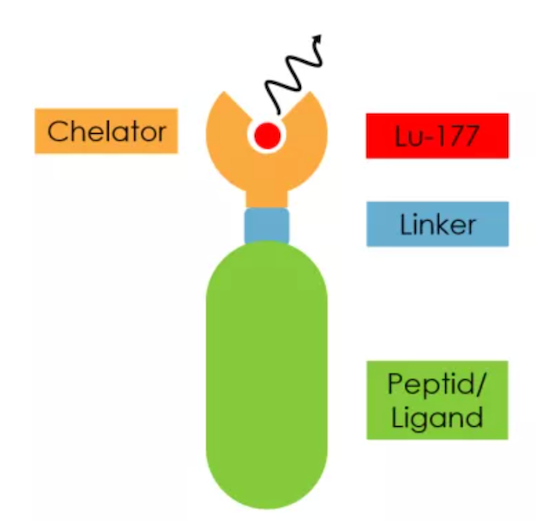
177Lu-PSMA-617结构
数据来源:诺华
CAR-T疗法
P-PSMA-101是Poseida公司研发的一款靶向PSMA 的自体CAR-T疗法。该疗法利用了Poseida专有的非病毒piggyBac DNA修饰系统开发,该系统产生的候选产品具有高比例的干细胞样记忆T细胞(TSCM)。与其他CAR-T细胞相比,TSCM细胞具有自我更新能力,产品疗效有望更加持久、毒性更小。
2020年5月,P-PSMA-101启动了治疗mCRPC的Ⅰ期临床研究。7月,一例受试者死于肝功能衰竭,因此,试验被FDA叫停。Poseida公司解释该症状为巨噬细胞活化综合征(MAS),是由免疫系统的过度激活引起。11月,在Poseida更改了试验方案以提升患者依从性和药物安全性后,FDA解除了对该试验的临床限制。
除了靶向PSMA的自体CAR-T细胞疗法外,公司还在探索靶向PSMA的异体CAR-T疗法P-PSMA-ALL01,该疗法目前尚处于临床前阶段。
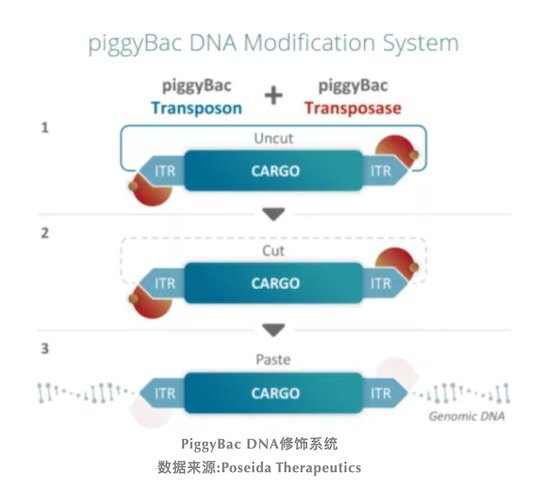
PiggyBac DNA修饰系统
数据来源:Poseida Therapeutics
前列腺癌向来被称为“男性杀手”,晚期预后较差。PSMA作为前列腺细胞膜表面特异性肿瘤标志物,近年来受到大量的关注,靶向PSMA的双抗、RLT、CAR-T疗法纷纷登场。从目前的研发进展而言,CD3×PSMA的双抗药物临床进展并不顺利,免疫原性过高的问题仍未得到很好的解决。诺华针对PSMA的放射配体疗法数据亮眼,有望于2022年获批上市,但缺点在于不良事件发生较高。Poseida公司靶向PSMA的CAR-T疗法未出现严重CRS事件,令人影响深刻,受MAS影响更改了试验方案后,后续的临床数据值得持续追踪。