7月22日,辉瑞宣布与PROTAC先驱Craig Crews教授创办的Arvinas公司达成一项全球合作协议,以开发和商业化Arvinas公司的蛋白降解剂ARV-471。根据合作协议,辉瑞将向Arvinas支付6.5亿美元预付款,3.5亿美元的股权投资以及14亿美元里程碑金额。
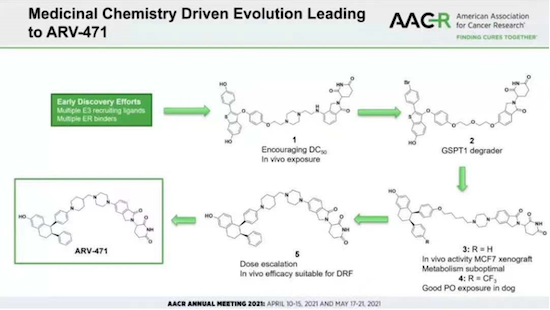
ARV-471结构
PROTAC蛋白降解技术
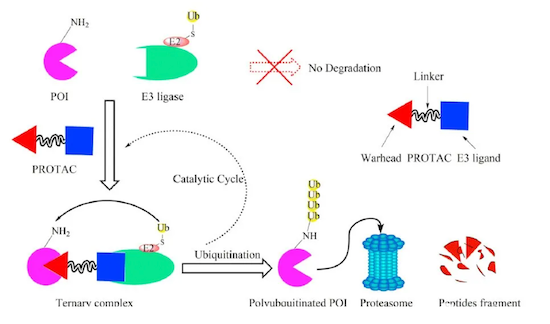
PROTAC作用特性:
“事件驱动(event driven)”,而非“占位驱动 (occupancy driven)”
无论小分子抑制剂,还是大分子抗体,都需持续占据靶蛋白的活性位点以阻断功能,属于“占位驱动 (occupancy driven)”。
这就需要药物满足:足够大的剂量,使靶点饱和;足够长的半衰期,能持续抑制;足够高的亲和力,“抢得过原装(配体/受体)”。因此产生很多问题,如剂量大,毒副作用也大;亲和力太高,容易导致脱靶毒性;靶点突变/过表达,出现耐药。
而由于PROTAC只是提供结合活性,触发靶蛋白与E3酶结合从而引发降解这一事件,属于“事件驱动(event driven)”,不需要直接抑制目标蛋白的功能活性,药物不需要与目标蛋白长时间和高强度的结合,因此可以靶向传统难以成药的蛋白(undruggable target)。
PROTAC的优势明显:
1.催化降解功能。
传统的小分子采用的药理学作用模式为占据驱动模式,为了提高靶点占有率,往往需要高剂量的药物,反而会带来很大的毒副作用。PROTAC采用的是事件驱动(event-driven)的药理学作用模式,其对目的蛋白的降解过程是一种催化作用,因此只需较低的化合物浓度便可以达到很好的降解效率。
2.选择性。
现代药物开发的一个关键目标是设计高选择性分子,降低药物毒性和副作用。PROTAC分子发挥催化作用时,可以选择性的作用于特定的靶蛋白。此前多项研究表明, PROTAC对同源靶蛋白的选择性高于传统抑制剂。
3.作用靶点广。
泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,参与细胞内80%以上。E3泛素连接酶在多种细胞中广泛表达,PROTAC分子只需将靶蛋白与E3泛素连接酶拉近,再通过蛋白溶酶体降解靶蛋白。因此PROTAC技术可以广泛应用不同的靶点。
4.延长作用时间。
靶蛋白的降解是时间依赖性的,PROTAC可以在几分钟内将细胞内靶蛋白消耗到接近基础水平。一旦先前存在的蛋白耗尽,PROTAC只需要降解重新合成的靶蛋白,大多数蛋白质的再合成速度很慢,即使在PROTAC完全清除后,细胞可能仍需要一段相当长的时间,才能将蛋白质库恢复生理信号的水平,从而大大延长作用时间。虽然口服给药通常被认为是小分子药物的首选给药途径,但患者的依从性,特别是对于更慢性的疾病,可能非常差,严重限制了治疗效果。PROTAC可以通过多种途径提供,提供更多有吸引力的临床给药方式。
5.新的药理学作用模式。
许多蛋白靶点对药物研发提出了挑战,它们可能没有一个特定的催化活性位点,需要依赖于更大的蛋白质界面来介导信号,或者蛋白质可能具有多个功能和催化结构域。识别高亲和力抑制剂对于这些靶点来说几乎是一个不可能的事件,但是PROTAC技术可以提供一种解决方案,因为只需要粘合剂(与传统抑制剂相反)来促进E3连接酶的募集和降解级联的启动。PROTAC的另一个优势是其表型基因敲除的能力,利用PROTAC可以作为研究靶基因功能序列丢失的有力补充手段。
PROTAC靶向多种蛋白质
的研究进展
蛋白激酶:BCR-Abl,BTK,c-Abl,ALK,CDK2,CDK4/CDK6,CDK8,CDK9,PI3K,Abl,FLT-3,AKT1-3,FAK,TBK1,SGK3,IRAK4,EGFR,PTK2,MEK1,MEK2,TrkC,JAK,PLK1,CK2,MCL1,BCL-2/BCL-XL和Wee1;
核受体:AR,ERα,细胞维甲酸结合蛋白[CRABPs];
转录调节蛋白:BRD4、BET、HDAC6、BCL6、Pirin、MDM2、STAT3、Smad3、Aiolos(IKZF3)、IKZF1、IKZF、PRC2(EED、EZH2和SUZ12)
调节蛋白:RIPK2、Sirtuin 2、PCAF/GCN5、FKBP12、PARP1和TGF-β;
其他:KRASG12C、Tau、α1A肾上腺素能受体[α1A-AR]、IDO1、CYP1B1、BAF复合物和PDEδ等。
表1 靶向蛋白激酶的代表性PROTAC


表3 靶向转录调节因子的的代表性PROTAC
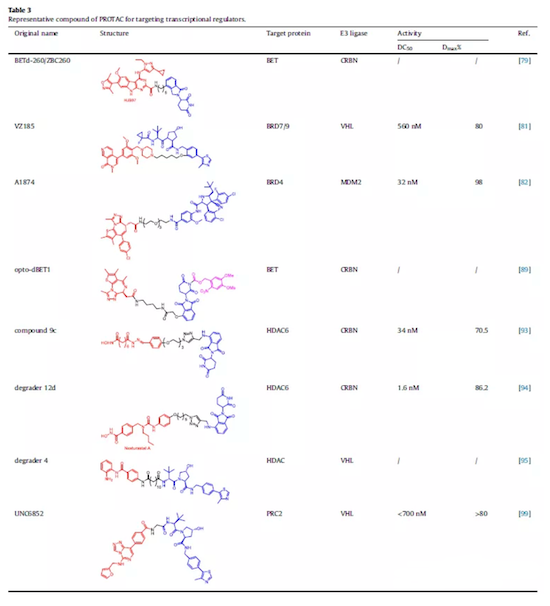
表4 靶向其他蛋白质的的代表性PROTAC

表5 靶向耐药蛋白的代表性PROTAC

表6 用于提高选择性和特异性的的代表性PROTAC

表8 影响激酶非依赖性功能的代表性PROTAC
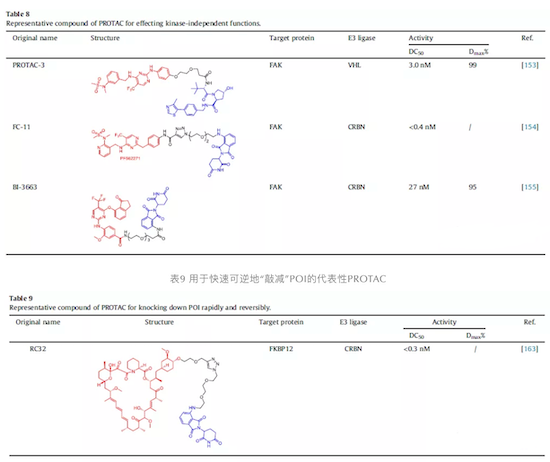
表10 对一些挑战靶点降解的代表性PROTAC