说起大脑免疫,大家第一时间想到的应该是大脑间质中普遍存在的小胶质细胞。
然而,近年来,科学家发现脑膜中存在大量外周可见的免疫细胞。这些免疫细胞究竟是从哪里来的,目前仍未可知。
前几日,《科学》杂志背靠背刊出华盛顿大学医学院Jonathan Kipnis团队和Marco Colonna团队关于大脑免疫的重磅研究成果。
他们的研究成果首次表明,脑膜中的髓样细胞[1]和B细胞[2]主要来源于颅骨骨髓,而非外周循环;而且这里的B细胞在脑膜而不是在公认的骨髓中成熟和发育[2]。
他们还再次证实:颅骨与硬脑膜之间存在直接的血管通道,可运送免疫细胞。
这两项研究共同指明:大脑与外周器官不同,具有一个“自给自足”的相对独立的免疫系统。这也打破了学术界对于免疫系统的传统认知。
这为日后脑部疾病的免疫学基础研究和临床研究都做出了巨大的贡献。
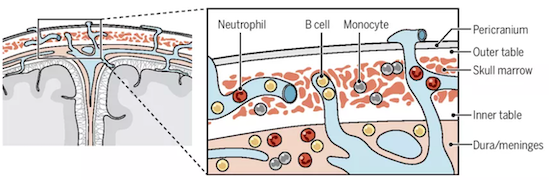
颅骨-脑膜的直接血管通道使得免疫细胞可从颅骨迁移至脑膜
下面,我们将逐一介绍这两个重要发现。
第一篇文章是圣路易斯华盛顿大学Jonathan Kipnis课题组的研究成果。
他们探讨的问题是:大脑的髓样细胞,尤其是脑膜处的驻留单核细胞,单核细胞来源的巨噬细胞,以及中性粒细胞是从何而来,它们在大脑生理病理过程中扮演什么角色。
Kipnis团队注意到,之前就有研究发现颅骨骨髓与脑膜间存在骨化的血管通道,并且炎症情况下,中性粒细胞可以从颅骨中趋化迁移到脑膜[3,4]。

论文首页截图:颅骨骨髓和椎骨骨髓为脑膜和中枢神经间质髓样细胞库
因此,他们猜想颅骨骨髓是大脑的髓样细胞库,在生理状况下,这些血管通道能将髓样细胞输送到脑膜,髓样细胞在这里起到哨兵的作用;在病理情况下,位于脑膜的髓样细胞会浸润进入脑间质。
为了证实这一猜想,他们首先构建了联体共生模型(WT小鼠和通体表达GFP的小鼠)。基于此,他们发现:WT小鼠脑膜髓样细胞中少有GFP标记细胞,与此相对的是,脾脏和外周血中GFP标记的髓样细胞比例较高。
这意味着:脑膜髓样细胞(主要为Ly6C+单核细胞和中性粒细胞)并非来源于血液。
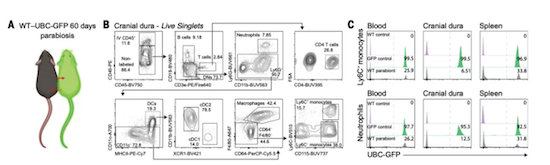
联体共生模型和WT小鼠体内的免疫细胞流式分析结果
如果不是来自于血液,那么脑膜的髓样细胞究竟来源于哪里呢?
是该组织内的已有的髓样细胞的扩增和自我更新?还是迁移自某处呢?
Kipnis和他的同事用一系列精细设计的EdU和Ki67活体标记实验表明:脑膜的髓样细胞并非来源于脑膜原有细胞的扩增和自我更新,而是来源于附近的骨髓,很可能就是颅骨骨髓。
他们还发现,颅骨骨髓内存在单核细胞-树突状细胞前体细胞(MDPs)和单核细胞前体细胞(cMoPs),进一步支持了上述发现。
为了直接证明颅骨骨髓髓样细胞可以迁移到脑膜,他们又设计了一轮精细的小鼠颅骨移植手术。他们在保证颅骨下的脑膜不受损的前提下,从GFP小鼠头上取一块大约6mm x 4mm大小的颅骨,然后在WT小鼠同一位置去除同样大小的颅骨,接着将GFP小鼠的颅骨移植入WT小鼠中,7天或者30天后对接受移植的WT小鼠进行实验分析。
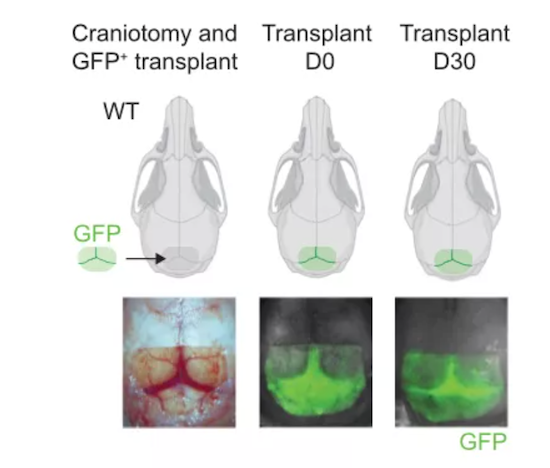
颅骨移植方法
免疫组化和流式结果均表明:接受移植的WT小鼠脑膜中存在GFP标记的细胞,包括CCR2+单核细胞,IBA1+巨噬细胞。这也就直接证明颅骨骨髓内的髓样细胞可以迁移到脑膜。
随后,通过对生理状况下脑膜细胞的单细胞测序,Kipnis和他的同事发现:脑膜细胞高表达CCL2,CCL12和CCL8,这也就意味着脑膜可以通过CCR2信号通路募集单核细胞。此外,脑膜细胞还高表达CCL6,这意味着脑膜可以通过CCR1信号通路募集中性粒细胞。这就是为何髓样细胞可以进入脑膜的原因。
最后,Kipnis团队还探究了这些脑膜内的髓样细胞在多种病理情况下扮演的角色。
在WT和GFP小鼠的联体共生体系中,他们分别诱导了EAE(实验性自身免疫性脑脊髓炎)模型,脊髓受损模型和视神经夹伤模型。
除EAE模型中脑内的中性粒细胞主要来源于血液之外,他们发现,趋化到脑内或者脊髓内的Ly6C+单核细胞和中性粒细胞主要来源于颅骨/椎骨骨髓,而且一定程度上这些Ly6C+单核细胞分化成为了巨噬细胞。
而对EAE模型中脑内免疫细胞的单细胞测序则表明:来自颅骨骨髓的单核细胞和来自外周循环的单核细胞存在显著差异(见下图)。这些基因差异表明血液来源的单核细胞更可能是炎症性细胞,也就说明两个来源的细胞各具特色,在这些疾病中起到了不同的免疫作用。

血液来源(GFP+)和颅骨来源(GFP-)基因表达差异
好,接下来我们来看看第二篇对于脑膜内B细胞的探索。
第二篇文章同样来自于华盛顿大学医学院,通讯作者是Marco Colonna。
同髓样细胞一样,脑膜淋巴细胞也被公认为是从外周循环而来,不过,最近的研究开始质疑这个观点。比如之前的研究发现颅骨和脑膜之间存在直接血管通道。除此以外,还有文献指出小鼠中枢神经系统存在一群未成熟B细胞[5,6]。

论文首页截图:脑膜B细胞异质性揭示中枢神经系统边缘存在淋巴巢
由于外周循环中很少有未成熟B细胞,因此,Colonna和他的同事猜想:脑膜B细胞是来源于颅骨造血,且在脑膜中成熟,而非从外周循环而来。
为了证实这一猜想,他们首先通过流式细胞术发现脑膜中的B细胞大致占所有免疫细胞(CD45+)的30%;然后又用双光子活体成像技术发现这些脑膜B细胞主要位于血管外,并且相对静止,这与血管内循环B细胞的快速运动相反。
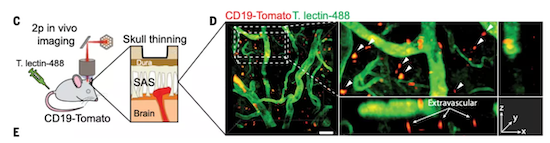
双光子成像,B细胞为CD19-Tamato细胞
之前,已经有研究团队曾对小鼠脑内的免疫细胞做过单细胞测序,发现脑内B细胞可以分为两大类,未成熟和成熟B细胞[5]。
Colonna组为了进一步探究脑膜B细胞的组成,就对那些公开的转录组数据(GSE98969)按照Ig转录物重新进行了分析。
他们发现所有的B细胞都表达B细胞标志基因,即Cd79b和Cd19。不过值得注意的是,这些B细胞不同程度地表达成熟B细胞基因(H2-Aa和Ms4a1)或者未成熟B细胞基因(Rag1和Cd93)。这也就意味着这些在中枢神经系统的B细胞处于发育的各个阶段。
接着,他们利用流式细胞术将脑膜B细胞与外周骨髓、血液及脾脏内的B细胞进行了表型比较,结果表明脑膜B细胞的特征与外周骨髓相似:都包括早期B细胞(CD19+B220loCD43hi),晚期B细胞(CD19+B220loCD43lo)和成熟B细胞(CD19+B220hiCD43-);而血液和脾脏则只有成熟B细胞。
为了深入探索脑膜B细胞的异质性,他们又收集了不同组织(硬脑膜,血液和外周骨髓)的B细胞并进行了单细胞测序。利用UMAP分析,他们将这些组织的B细胞分为10个群(C0-C9),然后他们基于组织和群进行分类分析。
从研究结果来看,C0和C5群几乎都由血液B细胞所组成;C3,C6,C8和C9 则主要包括外周骨髓和脑膜B细胞,几乎不包含血液B细胞。这与上文提到的外周骨髓B细胞和脑膜B细胞表型相似的结果一致。
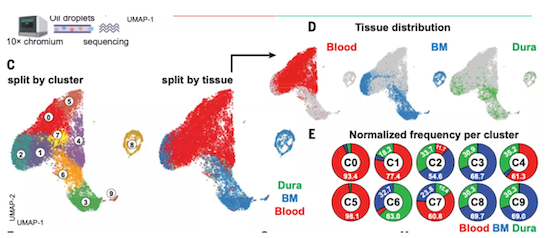
UMAP分析结果
随后,他们又通过差异性基因表达分析,对不同群的细胞进行归类。此结果表明:血液B细胞绝大多数为成熟初始B细胞(C0,C1,C2,C5),还包括很小一部分未成熟B细胞(C4)和B1b细胞(C7),这与公认的知识相符。
与此相对,外周骨髓和脑膜B细胞则包括成熟初始B细胞(C2),未成熟B细胞(C6),祖B细胞(C3),前B细胞(C9),以及分裂期B细胞(C8)。

差异性基因表达分析结果
因为上述结果表明脑膜B细胞处于不同发育阶段,所以作者们接下来还对这些测序结果进行了拟时间分析(pseudotime analysis),证实存在一条从分裂期B细胞→祖B细胞→前B细胞→成熟B细胞的发育轨迹。
他们还通过BrdU活体实验证明脑膜B细胞确实从分裂期B细胞开始发育为早期B细胞,然后发育为后期和成熟B细胞。
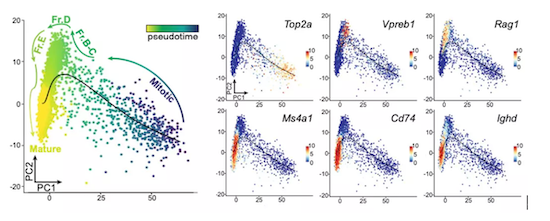
拟时间分析和B细胞发育轨迹
那么,接下来的问题就是,这些位于脑膜的B细胞是从何而来呢?
因为上述研究已经证实血液中的B细胞主要为成熟B细胞,还有很小一部分未成熟B细胞,所以脑膜B细胞不太可能来源于外周循环。
因此,Colonna和他的同事猜想它们来源于颅骨。
他们很快就发现颅骨的尾部存在一个较大的造血巢,其中有多种免疫细胞,包括IL7R+早期B细胞。类似第一篇文章,通过CD45.1-CD45.2联体共生等实验,他们发现脑膜B细胞并非来源于外周循环。此外,颅骨-脑膜的免疫荧光成像等实验也证明:B细胞可以从颅骨骨髓直接通过血管通道迁移到脑膜。

tdTomato标记的B细胞在颅骨-脑膜血管通道内
学过基础免疫学的同学们都知道:B细胞在骨髓中成熟,在骨髓内完成阳性选择和阴性选择的发育阶段,最终成为成熟初始B细胞,在这个过程中骨髓基质细胞起到了至关重要的辅助作用。
而Colonna团队发现脑膜B细胞的发育则不同:这些B细胞在颅骨骨髓内产生,然后在脑膜成熟。
那随之而来的问题就是:是哪种细胞帮助它们成熟的?
Colonna和他的同事注意到,先前有文献报道脑膜的成纤维样细胞一个标志性基因表达为Cxcl12[7],巧的是,研究人员发现脑膜的早期B细胞表达Cxcr4,CXCR4/CXCL12这条信号通路就打通了,这也就意味着成纤维样细胞可以招募B细胞。
随后的NicheNet分析也表明这两种细胞存在高度相互作用关系。除此以外,免疫荧光成像也表明它们之间有密切接触。
基于这些发现,Colonna团队推断:很有可能是脑膜的成纤维样细胞帮助B细胞在此处的发育和筛选。
最后,Colonna团队还对年老小鼠进行了类似的研究。
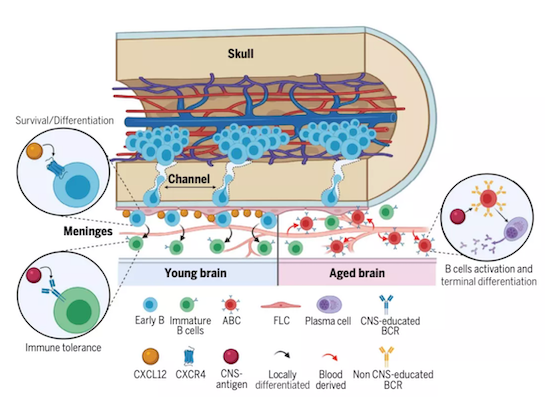
意外的是,他们发现年老小鼠脑膜内竟存在一些从外周趋化而来的B细胞。这些B细胞已接触过抗原,被研究人员称为衰老相关B细胞(ABCs)。
相较于年轻小鼠,年老小鼠脑膜内也有更多的浆细胞(主要是IgM型)。不过与成熟ABCs不同的是,绝大多数浆细胞不是从外周而来,作者们认为很可能是从外周趋化来的ABCs在此经历末端分化成为浆细胞。
这一意外的发现表明:随着年龄增长,中枢神经系统原本相对独立的免疫环境会受损,而外周的免疫细胞的侵入可能促进了一些病理情况的发生。
考虑到B细胞在自身免疫疾病和一些神经炎症疾病中的重要作用,这从一定程度上解释了为何这些疾病会随着年老的增长而更常见。
总的来说,这两篇文章证明了脑膜的髓样细胞和B细胞主要来源于颅骨,为此,颅骨-脑膜的血管通道的存在起到了关键性作用。髓样细胞在病理情况下还会从脑膜入侵至脑间质,起到与血液来源或者小胶质细胞不同的免疫功能。未成熟B细胞从颅骨迁移到脑膜后,在成纤维样细胞的帮助下成熟。
这些发现颠覆了传统观念,证明了大脑的免疫系统与外周其他器官不同,是一个较为特殊和独立的存在。而且第二篇文章还指出,这个独立特殊的免疫环境会随着年龄增长而受损,或与一些脑部病变有关。
值得一提的是,这两项研究还为脑部疾病比如肿瘤的免疫疗法提供了新的思路:或许可以从颅骨-脑膜入手,通过改变这一微环境(而非外周)中免疫细胞的活动来达到治疗效果。

奇点上新
这次的课程,我们用10讲系统梳理了晚期肺癌治疗20年的风云变幻。细致盘点了靶向治疗的最新进展,也全面展现了罕见靶点研究的勃勃生机。
当然免疫治疗也是重中之重,我们会带你再次洞察免疫治疗的深层机制,深入免疫治疗最前线,探讨迈入无化疗时代的治疗选择,一起见证辅助和新辅助治疗开疆拓土的战绩。
除此之外,我们还会和你一起凝视纷繁复杂的生物标志物研究,探究免疫治疗新靶点的无限潜力。

当然,深度不意味着晦涩,复杂不等同于繁复。我们竭尽全力将这些庞杂的知识点融汇成精湛的音频课程,让你听得轻松、顺畅,不头大,让这些知识快速整合到我们的认知体系,成为下一步进阶的土壤。
说了半天,这么好的课程,原价只需39.9元,认证购买仅需9.9元,也就半杯奶茶的钱!既然看到这里了,就立刻扫描下方二维码,购买收听起来吧!

参考文献:
[1]Cugurra A, Mamuladze T, Rustenhoven J, et al. Skull and vertebral bone marrow are myeloid cell reservoirs for the meninges and CNS parenchyma [published online ahead of print, 2021 Jun 3]. Science. 2021;eabf7844. doi:10.1126/science.abf7844
[2]Brioschi S, Wang WL, Peng V, et al. Heterogeneity of meningeal B cells reveals a lymphopoietic niche at the CNS borders [published online ahead of print, 2021 Jun 3]. Science. 2021;eabf9277. doi:10.1126/science.abf9277
[3]Herisson F, Frodermann V, Courties G, et al. Direct vascular channels connect skull bone marrow and the brain surface enabling myeloid cell migration. Nat Neurosci. 2018;21(9):1209-1217. doi:10.1038/s41593-018-0213-2
[4]Cai R, Pan C, Ghasemigharagoz A, et al. Panoptic imaging of transparent mice reveals whole-body neuronal projections and skull-meninges connections. Nat Neurosci. 2019;22(2):317-327. doi:10.1038/s41593-018-0301-3
[5]Keren-Shaul H, Spinrad A, Weiner A, et al. A Unique Microglia Type Associated with Restricting Development of Alzheimer's Disease. Cell. 2017;169(7):1276-1290.e17. doi:10.1016/j.cell.2017.05.018
[6]Mundt S, Mrdjen D, Utz SG, Greter M, Schreiner B, Becher B. Conventional DCs sample and present myelin antigens in the healthy CNS and allow parenchymal T cell entry to initiate neuroinflammation. Sci Immunol. 2019;4(31):eaau8380. doi:10.1126/sciimmunol.aau8380
[7]Rustenhoven J, Drieu A, Mamuladze T, et al. Functional characterization of the dural sinuses as a neuroimmune interface. Cell. 2021;184(4):1000-1016.e27. doi:10.1016/j.cell.2020.12.040