为了解我国宠物类病毒类制品的质量情况,本文汇总了2008-2020年承担的所有类别(包括注册检验、复核检验和监督检验)的宠物用病毒类生物制品检验情况,对检测出的不合格批次及检验项目进行了统计分析,提出了做好宠物用病毒类制品质量控制和重点品种研发的建议。
疫苗类:包括活疫苗(传统弱毒活疫苗)、灭活疫苗(全病毒灭活疫苗)以及细菌(如钩端螺旋体)和病毒多联多价苗。诊断制品类:抗体检测试剂或试剂盒(如ELISA试剂盒)以及抗原或核酸检 测试剂或试剂盒(如ELISA试剂盒、胶体金试纸条、RT-PCR试剂盒等)。
截至2020年,我国已批准约47个宠物类生物制品(表1- 表4、图1),包含一类新兽药2个(占比4.3%),二类新兽药10个( 占比 21.2%), 三类新兽药25个(占 比 53.2%),进口新兽药10个(占比21.3%)。


从疫苗使用对象看,犬用疫苗25个(占比89% ),猫用疫苗3个(占比11% ),其中狂犬病疫苗(含联苗)共16个(表2),占比57% 。 已批准 宠物用诊断试剂14个,其中犬用诊断试剂12 个 (占比86% ),猫用诊断试剂2个(占比14% ),所有诊断试剂中狂犬用诊断试剂6个,占比43% 。
从产品来源看,国产疫苗和进口疫苗各占一半(均为14个),诊断试剂均为国产。 综合已批准的所有宠物 类制品,狂犬病相关生物制品为主要品种,共批准22个(表2、表3),其中疫苗16个,诊断制品6个, 约占宠物类生物制品的 47% 。
2.2008-2020 年我国宠物用病毒类生物制品质量检验情况分析
2.1 宠物用病毒类生物制品不合格批次及主要不合格项目情况 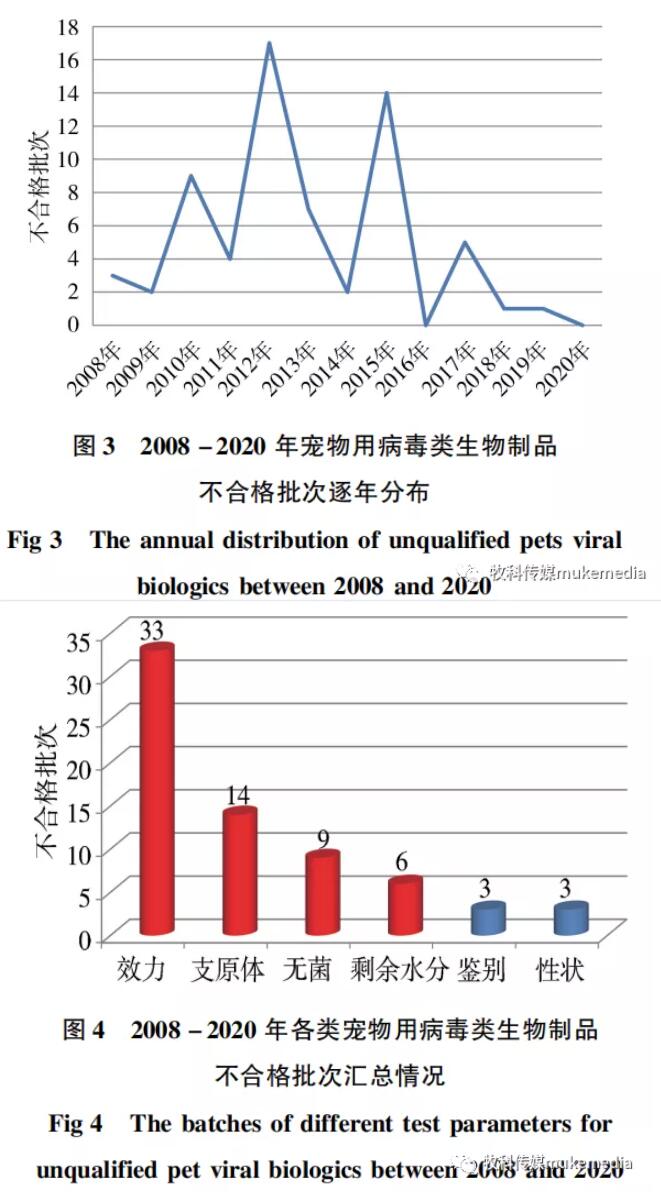

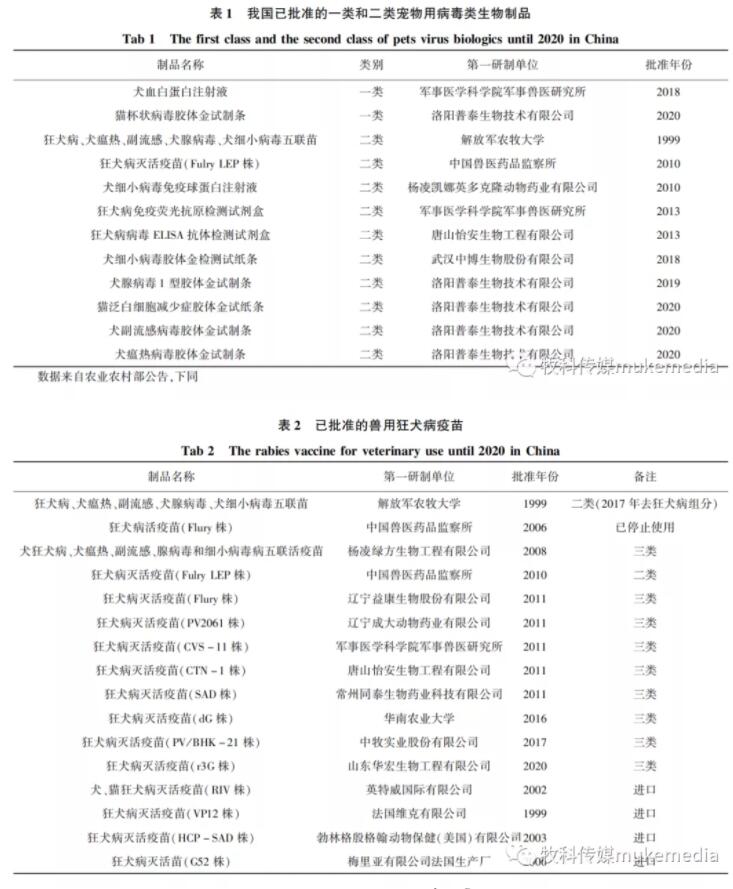
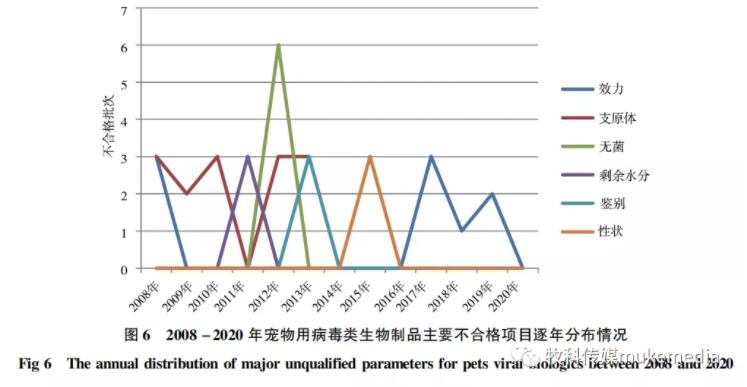
由图3-图5可知,2008-2020年共检出不合格宠物用病毒类制品68批,年均不合格批数约为5批,不合格项目主要集中在效力、支原体、无菌、剩余水分等4个参数,占比分别为49%、21%、13%、9% ,合计占所有不合格项目的比例为92% ;性状和鉴别合计约占8% 。从主要不合格项目逐年分布情况看(图6),效力检验不合格是近五年各类检验最突出问题,纯净性检验(支原体和无菌)是需要持续关注的项目,而剩余水分、性状和鉴别检验不合格仅为不同年份个别产品出现的问题。
2.2 宠物用病毒类生物制品不合格风险较大产品
从2008-2020年宠物用病毒类生物制品检验情况看,狂犬病灭活疫苗、狂犬病活疫苗(已停止使用)、犬细小病毒活疫苗(进口)、犬狂犬病、犬瘟热、副流感、腺病毒和细小病毒病五联活疫苗和犬瘟热、腺病毒病、细小病毒病、副流感四联活疫苗-犬钩端螺旋体病(犬型、黄疸出血型)二价灭活疫苗(进口)以及抗CDV、CPV免疫球蛋白为主要不合格产品。对于狂犬病灭活疫苗,其主要不合格项目为效力、无菌和性状,其中效力不合格占该制品不合格批次的比例为82%(图7),需特别关注。 宠物类诊断试剂(盒) 未检出不合格产品,说明产品质量稳定。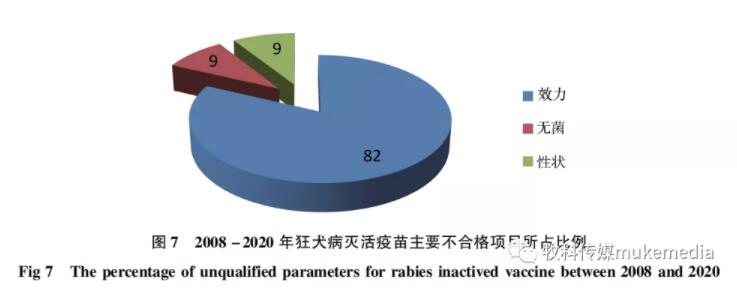
2.3 宠物用病毒类生物制品不合格批次在各类检验中的逐年分布情况
从宠物用病毒类生物制品不合格批次在各类检验中的逐年分布情况看(图8),2009、2014-2015不合格批次主要为监督 检验样品,2010-2015年(除个别年份外) 不合格批次主要集中在注册检验样品,2008年、2012年以及2017年以来不合格批次主要为文号复核检验样品,提醒必须加强已批准制品的生产和检验过程的质量控制。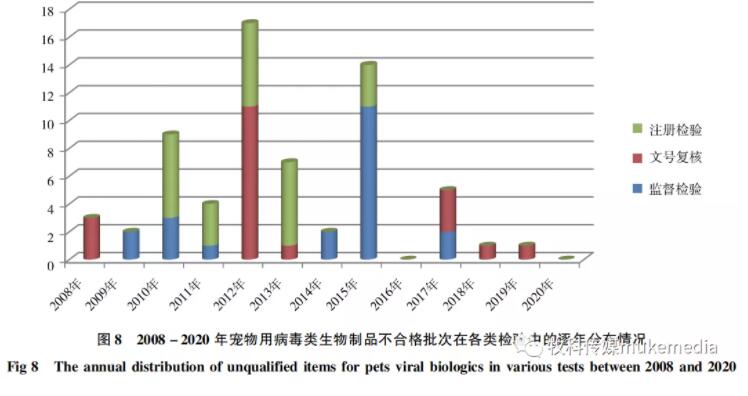
2.4 宠物用病毒类生物制品各类检验的主要质量风险点
从宠物用病毒类生物制品不合格项目在各类检验中的分布情况看(图9),效力检验和支原体检验是各类检验都应密切关注的主要质量风险点,效力检验、支原体检验、无菌检验和性状是监督检验需重点关注的质量风险点,效力检验和支原体检验是文号复核检验的主要质量风险点。对于注册检验,不同产品存在不同的质量风险点,需从研发和检验各环节统筹把控。
3.1 完善兽用狂犬病灭活疫苗效力检验通用方法
狂犬病相关制品约占我国宠物类病毒制品的47%(22/47),狂犬病疫苗占已批准宠物疫苗的57%(16/28),其中狂犬病灭活疫苗占已批狂犬病疫苗(或联苗)的 81.3% (13/16),是企业申报最多的品 种以及国家监督抽检的重点产品。 从2008-2020年宠物类生物制品各类检验统计结果看,狂犬病灭 活疫苗是主要的质量风险制品之一,且效力检验为主要质量风险点 ( 约占该制品不合格参数的82%)。 与美国和欧盟均采用统一的NIH标准方法不同,《中国兽药典》(2020年版)才发布我兽用狂犬病灭活疫苗NIH法,但已批准不同厂家的该制品的效力检验NIH方法在免疫程序、攻毒毒株、参考疫苗、计算公式以及使用的小鼠的品系、样品稀释比例、攻毒后观察天数等差异较大,难以比较其质量优劣。
与美国和欧盟的方法相比(表5),2020 年《中国兽药典》新增的NIH法仅作为附录推荐方法,还未作为已批准狂犬病灭活疫苗的统一方法,且在标准的可操作性方面仍有进一步完善的空间:如尚未明确使用的小鼠品系、性别和体重,未统一参考疫苗供应机构以及效力计算方法,也未基于动物福利考虑将美国9CFR和《 欧洲药典》NIH法均推荐采用5个阶段的终点代替方法(表6)作为攻毒后结果判定标准。 
此外,欧洲药典已推荐将小鼠免疫中和抗体测定法作为NIH法的替代方法,建议我国可以借鉴国际经验, 尽快统一已批准狂犬病灭活疫苗的效力检验方法,并积极针对疫苗的体外抗原定量方法或免疫后血清的定量方法开展研究。
无菌、支原体、外源病毒是兽用生物制品纯净性控制的主要内容。 目前,我国宠物用病毒制品纯净性检验不合格占比为34% (外源病毒检验未检出),也是仅次于效力检验的主要质量风险点。对于无菌检验,除应严格按照GMP要求组织生产和检验外, 应将“处处防污染”理念贯彻始终,重点从原辅料检验、半成品检验、成品检验三个环节加强控制,建议应采用来源明确且质控合格的培养基,严格按照无菌检验标准操作规程进行检验和判定。 对于支原体检验,应聚焦细胞(细胞系)、种毒和牛血清等兽用生物制品支原体污染主要源头,牢固树立“预防为主”方针,严把细胞、种毒和血清等原辅材料“入口关”,严格执行种毒种子批制度、细胞种子库制度和原辅材料进厂检验制度,从穿衣戴帽戴口罩做起严防人员污染和物料交叉污染,严格生产车间和实验室的环境控制和操作控制,规范制定和执行支原体检验SOP以及定期抽检查验制度,在现行《中国兽药典》支原体检验方法基础上,增加DNA荧光染 色法作为法定方法之一,同时建立更敏感的PCR 方法作为企业内控方法,以解决目前兽用疫苗支原体污染问题。 对于外源病毒检验,尽管近年来未检出不合格制品,但BVDV、PIV5污染风险持续存在,且与美国、欧盟等国家(地区) 药典相比,即将实施的《中国兽药典》2020年版的宠物用细胞及其制品的外源病毒检验方法仍有进一步完善空间, 如《中国兽药典》2020年版对于犬猫用细胞及其制品,采用荧光方法检测仅检测牛病毒性腹泻病毒、犬细小病毒和狂犬病病毒等3种特定病毒,而美国9CFR §113.47规定除以上3种特定病毒外,犬源细胞和种毒还应检测呼肠孤病毒、犬冠状病毒、 犬瘟热病毒等特定病毒,猫源细胞和种毒还应至少检测呼肠孤病毒、猫传染性腹膜炎病毒和猫泛白细胞减少症病毒等特定病毒。建议应尽快开展我国宠物用病毒类生物制品外源病毒污染风险监测, 根据风险监测结果并借鉴国际上同类制品外源病毒控制要求,不断完善我国宠物类外源病毒检验方法。尽管我国已批准犬瘟热单克隆抗体和犬细小病毒单克隆抗体等2个单抗制品作为治疗性生物制品使用,但国家宠物用标准物质几乎空白,亟待开展相关研究。 对于宠物疫苗而言,多联或多价疫苗已成为已批准制品常态和研发趋势,采用常规方法制备的多克隆抗体存在试验动物筛选困难且特异性难以保证的问题,而单克隆抗体应该是一种较好选择。 目前,单克隆抗体作为中和用阳性血清已广泛应用于已批准的宠物用进口多联多价活疫苗的鉴别检验和外源病毒检验,采用单抗作为一抗或单抗 标记的荧光抗体也用于制品病毒含量测定以及外源病毒检测。 建议由中监所牵头组织攻关,尽快建立单克隆抗体为基础的宠物用标准物质库,不断夯实宠物用疫苗和诊断试剂研制基础。 从已批准的宠物用制品看,犬用疫苗和诊断试剂为主要申报品种,分别占已批宠物类疫苗和诊断试剂的89% 和86% ,而猫用疫苗和诊断试剂仅占11% 和14% 。 从产品品种看,犬用疫苗已涵盖狂犬病、犬瘟热、犬细小病毒病、犬副流感、犬腺病毒、犬冠状病毒病以及犬钩端螺旋体(犬型、黄疸出血型)等7种主要疾病,犬用诊断试剂基本与疫苗病原一致,其中狂犬病病原和抗体诊断试剂数量和品种最多,约占已批诊断试剂的43%(6/14)。 猫用疫苗主要为狂犬病、猫鼻气管炎、嵌杯病毒病、泛白细胞减少症等4种疫病且均为进口制品,诊断试剂仅有猫杯状病毒胶体金试制条和猫泛白细胞减少症胶体金试纸条2种,研发空间均很大。从研发角度看,基于国内犬猫流行毒株的多联多价疫苗、弓形虫等人畜共患寄生虫疫苗和检测试剂、猫用疫苗的国产化疫苗、野生动物用狂犬病口服标记活疫苗、狂犬病灭活疫苗体外抗原含量检测试剂盒和免疫后血清的定量检测试剂盒以及猫用疫病诊断试剂可作为今后一个 时期的研发重点。
参考文献:
[1] 杨京岚,陈光,夏业才,主译. 美国兽医生物制品法规和技术标准[M]. 中国农业出版社,2019:601 -606.
Yang JL,Chen G H,Xia Y C. The laws regulations and technical standards on veterinary biologics in the United States[ M ].China Agricultural Press, 2019:601 -606.
[2] European Pharmacopoeia Commission. European pharmacopoeia 9.0 [ S].
[3] 中国兽药典委员会. 中华人民共和国兽药典2020年三部[S]. 2020年版. 北京:中国农业出版社.
Chinese veterinaryPharmacopoeia Commission. Three volumes of the Veterinary Pharmacopoeia of the People 's Republic of China[S]. 2020 edition. Beijing:China Agricultural Press.
[4] 吴华伟,陈晓春,秦义娴,等.我国猪用病毒类生物制品质量情况分析及建议[J]. 中国兽药杂志,2019, 53( 1 ):23-25.
Wu H W ,Qin Y C,Gao J X ,et al. Analysis and suggestions onquality of swine virus biologics in China[J]. Chinese Journal ofVeterinary Medicine,2019,53( 1):23-25.
[5]夏业才,陈光华,丁家波. 兽医生物制品学(第2版)[M]. 中国农业出版社,2018:363-369.
[6] 吴华伟,秦义娴,陈晓春,等.首例兽用活疫苗种污染副流感病毒5型的检测[J]. 中国兽药杂志,2018,52(12):16 -23.
Wu H W , Qin Y X,Chen X C,et al. The first case of contamina-tion with parainfuenza virus 5 in veterinary live vaccine [J].Chinese Journal of Veterinary Drug, 2018, 52(12):16 -23.










