1月26日,英国生物技术公司Immunocore宣布FDA批准其创新TCR疗法KIMMTRAK ® (tebentafusp-tebn) 的上市,适应症为不可切除或转移性葡萄膜黑色素瘤患者。值得一提的是,KIMMTRAK是FDA批准的第一个也是唯一一个用于治疗不可切除或转移性葡萄膜黑色素瘤( mUM )的疗法,也是第一个获得监管批准的T细胞受体(TCR)治疗药物。同时,这也是首款用于治疗实体瘤的细胞疗法。

KIMMTRAK的批准是基于Immunocore的3期IMCgp100-202临床试验的结果,该结果发表在2021年9月23日的《新英格兰医学杂志》上。该随机关键试验评估了KIMMTRAK在先前未治疗的mUM患者中(均为HLA-A*02:01阳性)的总生存期(OS)。试验中,意向治疗人群以2:1的比例被随机分为两组,前者接受Kimmtrak的治疗,后者接受活性对照药物的治疗,数据显示,Kimmtrak作为一线治疗,患者死亡风险降低49%(HR=0.51,95% CI:0.37, 0.71,p<0.0001)。Kimmtrak组的中位总生存期为21.7个月,活性对照组为16.0个月。安全性上,治疗相关不良事件具有可控性。
据悉,Kimmtrak是第一个使用Immunocore的ImmTAC技术平台开发的TCR-T疗法,具有双特异性功能,创新性的将可靶向肿瘤抗原的TCR与能够和CD3受体结合的免疫效应结构域联合到一起,TCR部分靶向黑色素瘤相关抗原gp100,scFv部分则靶向CD3以募集T细胞。
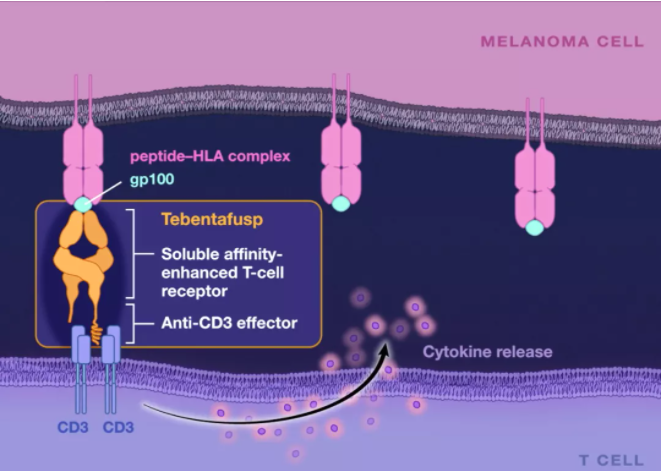
此前,Kimmtrak就已获得美国 FDA 授予的突破性治疗、快速通道和孤儿药物指定,以及英国转移性葡萄膜黑色素瘤早期获取药物计划下的有希望的创新药物( PIM )指定。
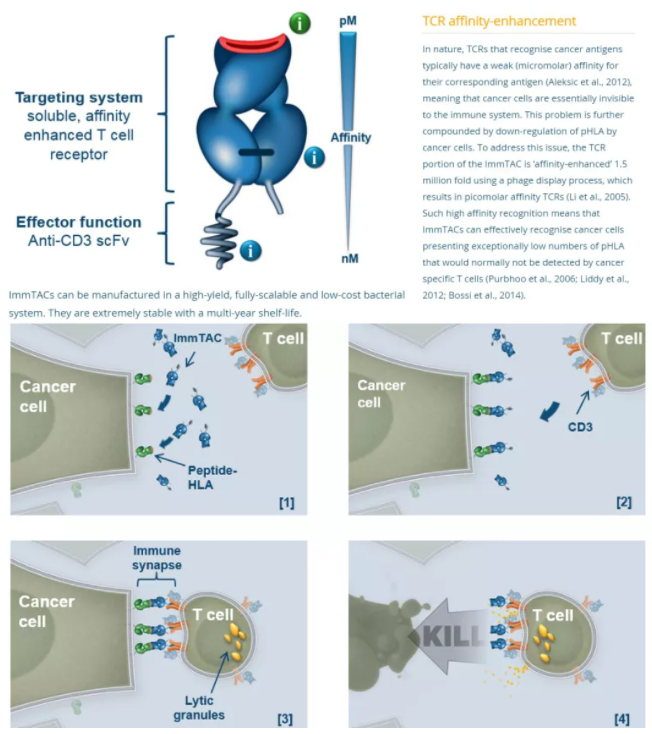
Immunocore的核心技术是基于TCR改造的ImmTAX(immune mobilizing monoclonal TCRs against X disease)平台。将人工改造后亲和力(pM水平)增强的天然TCR与效应子片段(nM水平亲和力)偶联成双特异性的ImmTAX分子,通过改变效应子片段驱动特定的免疫反应从而具备治疗广谱性疾病的能力。例如对于肿瘤或者传染病将效应子片段设计成抗CD3的单链抗体片段(scFv)用于募集、激活T细胞增强免疫反应,而对于自身免疫病则设计免疫抑制作用的效应子片段。
ACROBiosystems为助力双特异性抗体开发,提供品质卓越的CD3系列蛋白:CD3ε、CD3δ、CD3γ、CD3ε& CD3δ、CD3ε& CD3γ。高纯度经SDS-PAGE及SEC-MALS验证,高生物活性经与OKT3、SP34-2、UCHT1、CD3×BCMA等热门抗体的结合验证,符合药物开发要求,可加速抗体药物的开发进程。点击“阅读原文”,查看更多信息。订购、咨询请扫描下方二维码添加微信小助手。
参考来源:
https://globalgenes.org/2022/01/26/fda-approves-immunocores-kimmtrak-to-treat-unresectable-or-metastatic-uveal-melanoma/
https://ir.immunocore.com/news-releases/news-release-details/immunocore-announces-fda-approval-kimmtrakr-tebentafusp-tebn
Webinar
第87期

方显锋
广州昂科免疫
总经理
毕业于中科院生物物理所,先后在美国希望城贝克曼研究所、清华大学医学院免疫所从事博士后科研工作(T细胞免疫方向)。2018年参与广州昂科免疫生物技术有限公司创建,现任广州昂科免疫总经理。领导团队完成CD24Fc治疗重症新冠肺炎项目在中国的临床申报并获批(该项目最终被默沙东收购)和新一代靶向CTLA-4的创新免疫治疗药物ONC-392(I类新药)在中国的临床申报及临床试验。

广州昂科免疫生物技术有限公司是一家临床阶段的生物制药公司,由知名华人科学家刘阳教授和郑盼教授于2018年创立,公司致力于开发创新免疫治疗药物治疗癌症和自身免疫疾病。公司拥有多个自主研发产品包括一系列免疫检查点相关的一类原创新药的全球权益,并独占许可引进了刘阳教授开发的新一代CTLA-4抗体药物ONC-392和另一系列first in class产品ONC-78X的大中华区权益。ONC-392将于2022一季度在中国结束I期临床试验,由美国OncoC4 Inc申办的ONC-392 I期临床研究于2021年底发布的临床试验结果验证了刘阳教授提出的全新靶向CTLA-4肿瘤免疫治疗理论,也奠定了ONC-392在该领域的全球领先地位。广州昂科免疫自研的全球首创靶向CD24-Siglec通路用于重症新冠肺炎等炎症性疾病的免疫调节产品AI-071将于2022年进入临床开发阶段。
