2022年3月10日国家市场监督管理总局令公布第54号《医疗器械经营监督管理办法》,该办法自2022年5月1日起施行,原国家食品药品监督管理总局令第8号《医疗器械经营监督管理办法》同时废止,为便于广大医械从业人员掌握理解,达达的同事特将《医疗器械经营监督管理办法》(以下简称经营办法)修订的总体思路和原则及其条款变更对比梳理如下:
《经营办法》修订的总体思路和原则:
一是落实医疗器械注册人和备案人制度,强化其全生命周期质量安全责任。
二是严格落实“放管服”改革精神,简化有关申报资料和程序要求。
三是明确监督检查事权,强化监管举措。
四是增加监管措施,解决监管手段不足的问题。
五是加强执法监督,促进公正廉洁执法。
为体现最新的监管理念,新《经营办法》还坚持以下修订原则:
一是坚持分类管理原则。
经营第一类医疗器械不需许可和备案,经营第二类医疗器械实行备案管理,对产品安全性、有效性不受流通过程影响的第二类医疗器械可以免予经营备案,经营第三类医疗器械实行许可管理。
二是坚持企业主体责任原则。
为了突出企业经营环节责任,要求医疗器械经营企业应当按照法律法规和医疗器械经营质量管理规范要求,建立覆盖质量管理全过程的质量管理制度和质量控制措施,并做好相关记录,保证经营条件和经营活动持续符合要求。
三是坚持严格监管原则。
通过综合运用抽查检验、飞行检查、责任约谈、安全警示、信用档案等制度,丰富监管措施,完善监管手段,推动监管责任的落实。
四是坚持追踪溯源原则。
规定企业应当建立并执行进货查验记录制度。从事第二类、第三类医疗器械批发业务以及第三类医疗器械零售业务的经营企业应当建立销售记录制度。
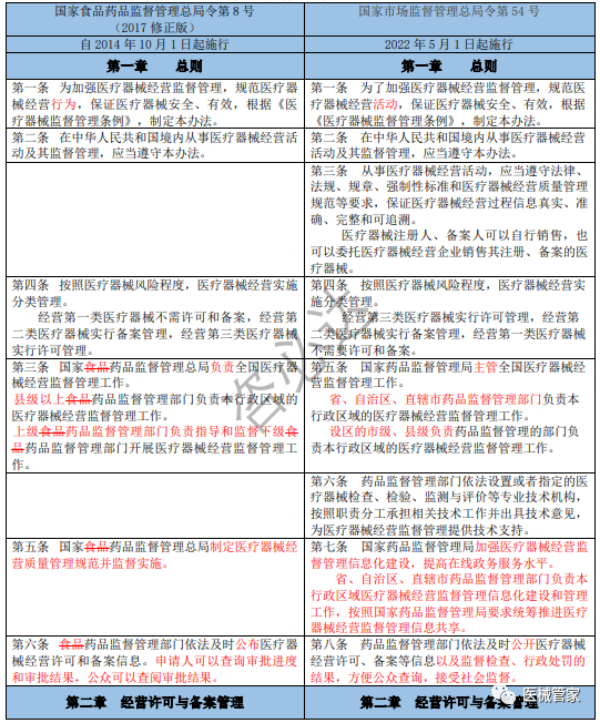
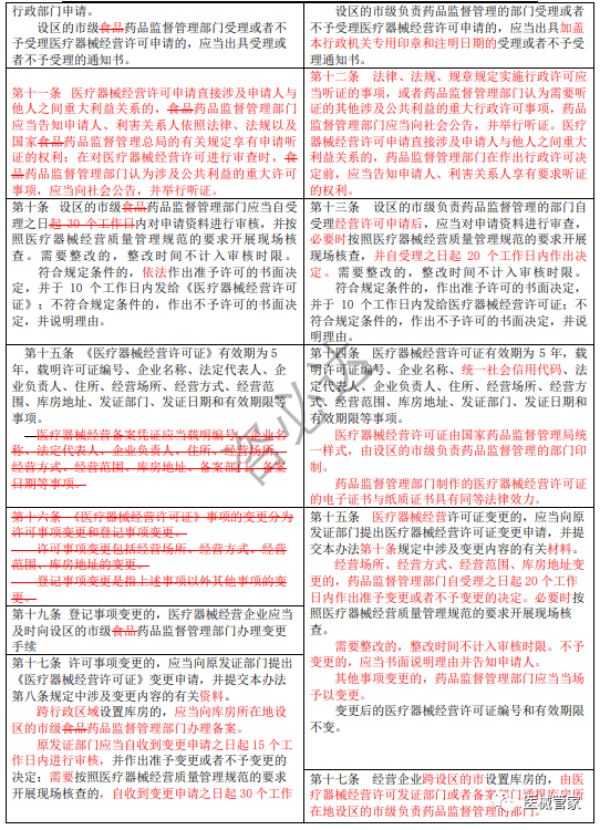
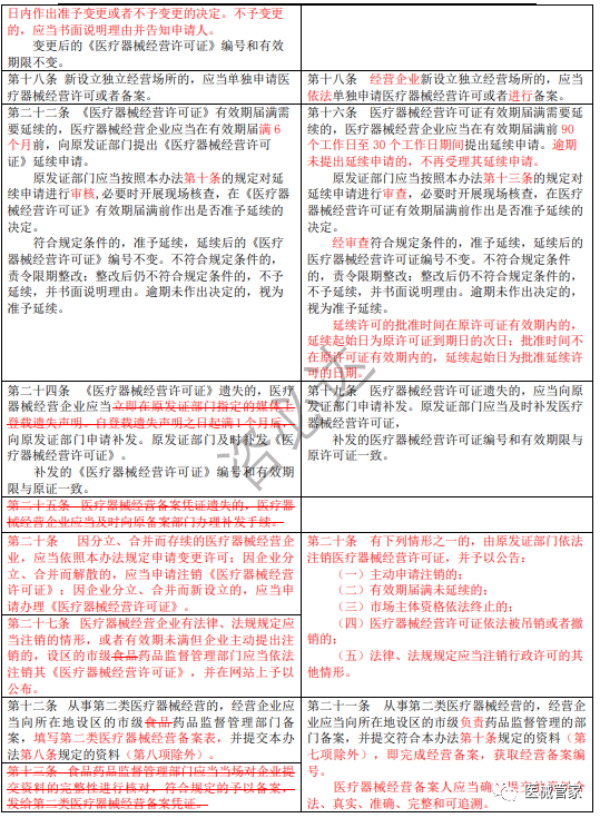
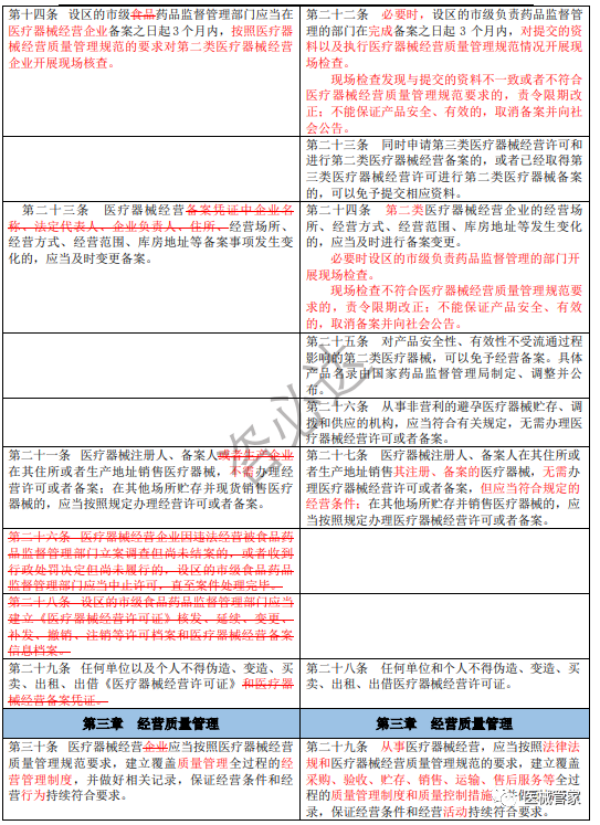
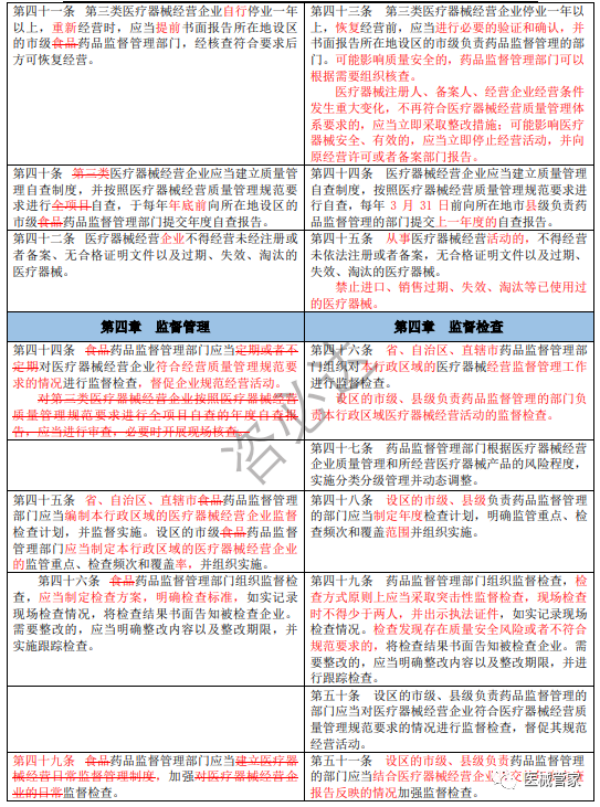
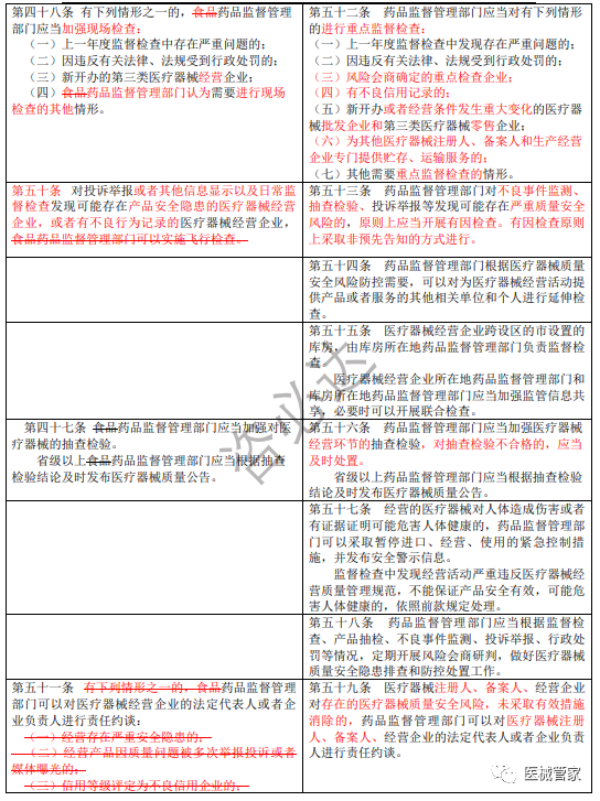
《医疗器械经营监督管理办法》新旧办法修订逐条对比
(红色为变更内容;红色删除线为删除原有要求)