随着A股及港股上市企业2022上半年业绩报告陆续披露,医药企业的研发投入也浮出水面。
TOP10企业合计研发投入超过200亿元,比去年同期增长约7%。百济神州稳居首位,半年研发投入50.16亿元,PD-1单抗拿下9个适应症;恒瑞医药稳居第二,研发投入29.09亿元,第11款新药、6个首仿获批,3款1类新药首次报产。
复星医药、中国生物制药、石药集团、迈瑞医疗、金斯瑞、信达生物排名均有上升,和黄医药、君实生物首次跻身TOP10。
2022H1研发投入TOP10医药企业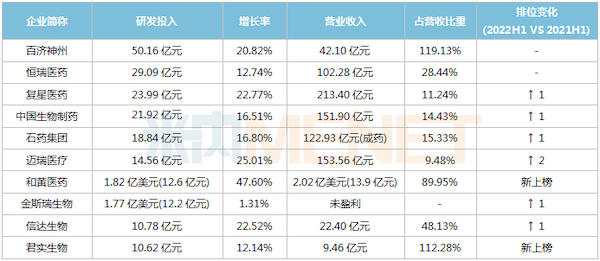
注:统计字段含研发投入、研发费用、研发开支等;汇率以9月2日计
来源:公司公告,米内网整理
01
百济神州:稳居“一哥”宝座,PD-1单抗拿下9个适应症
2022上半年百济神州研发投入50.16亿元,比去年同期增长20.82%,占营收比重119.13%,比去年同期增加34.25个百分点。其拥有一支超过2500名员工的全球临床开发与医学事务团队,正在为超过40种药物和候选药物执行近80项正在进行或已计划的临床试验。
目前百济神州国内已实现商业化的产品包括3款自主研发的1类新药,以及13款合作引进的新药。据公告,2022上半年,泽布替尼全球销售额15.14亿元,比去年同期增长263.1%;替雷利珠单抗国内销售额12.51亿元,比去年同期增长56.4%;安进授权产品国内销售额3.84亿元,比去年同期增长233.9%;百时美施贵宝授权产品国内销售额3.27亿元,比去年同期增长50%。
2022年至今百济神州获批上市品种
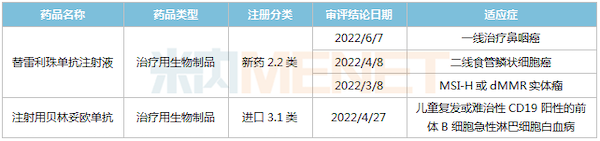
来源:米内网MED2.0中国药品审评数据库
2022年至今,替雷利珠单抗3个新适应症获批上市,至今已斩获了9个适应症,领跑国内其他国产PD-(L)1单抗;贝林妥欧单抗第2个新适应症获批,用于治疗儿童复发或难治性CD19阳性的前体B细胞急性淋巴细胞白血病。此外,5个新药获批临床,首次获批临床的BGB-23339是一款用于炎症和免疫领域的在研型强效酪氨酸激酶2(TYK2)变构抑制剂。
在新药申报方面,泽布替尼、替雷利珠单抗均有2个新适应症提交上市申请,此外,注射用BGB-B167、BGB-15025片等1类新药首次申报临床。
02
恒瑞医药:第11款新药、6个首仿获批,3款1类新药首次报产
2022上半年恒瑞医药研发投入29.09亿元,比去年同期增长12.74%,占销售收入比重28.44%,其中研发费用21.84亿元,占销售收入比重21.36%。恒瑞稳步推进国际化战略,报告期内海外研发投入5.19亿元,占总体研发投入的比重17.85%。
经过多年发展,恒瑞医药打造了一支5300多人的规模化、专业化、能力全面的研发团队,从多个维度主导和支持了国内外260多个临床项目。
2022年至今,恒瑞医药有2款新药(含新适应症)获批上市,其中瑞维鲁胺片为其在国内获批上市的第11款创新药(第10款1类新药),也是国内获批的首款国产AR抑制剂;吡咯替尼斩获第2个适应症,用于HER2阳性早期或局部晚期乳腺癌患者的新辅助治疗。
此外,9个品种获批生产并视同过评,其中有6个为首仿;4个品种通过一致性评价,其中有3个为首家。米内网数据显示,目前恒瑞医药已过评/视同过评品种达60个,其中首家过评品种31个。
2022年至今恒瑞医药报产的创新药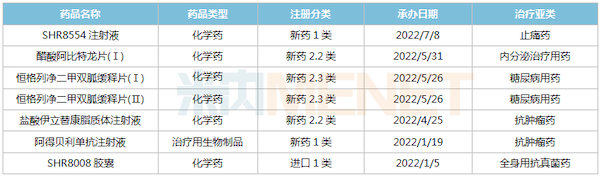
来源:米内网MED2.0中国药品审评数据库
3款1类新药首次提交上市申请,阿得贝利单抗为PD-L1单抗,用于治疗一线广泛期小细胞肺癌;SHR8008为CYP51酶抑制剂,用于治疗急性外阴阴道假丝酵母菌病;SHR8554为偏向型MOR激动剂,用于治疗腹部手术后中重度疼痛。此外,超过30个新药获得临床默示许可(不含补充申请)。
目前恒瑞医药有12款新药(6款为1类新药)首次报产在审,其中磷酸瑞格列汀片(DPP4抑制剂)、林普利司片(PI3kδ抑制剂)等有望拿下同靶点国产首个。
03
复星医药:半年研发投入首破20亿,首款生物1类新药获批
2022上半年复星医药研发投入23.99亿元,比去年同期增长22.77%,占销售收入比重11.24%。截至报告期末,复星研发人员超过2800人,其中超过1500人拥有硕士及以上学位;在研项目超260项,其中创新药70项,自研生物类似药13项,仿制药130项、一致性评价23项等。
报告期内,复星医药有2个创新药(适应症)、10个仿制药(适应症)于中国境内/美国获批上市;1个创新药(适应症)、18个仿制药(适应症)于中国境内申报上市;14个创新药(适应症)、9个仿制药(适应症)于中国境内获批开展临床试验。
2022年至今复星医药国内获批上市的部分品种
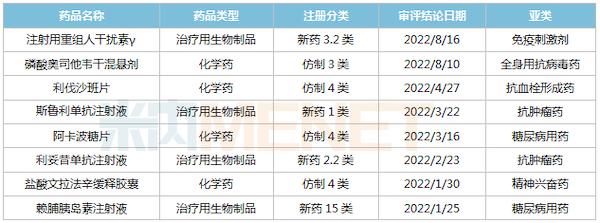
来源:米内网MED2.0中国药品审评数据库
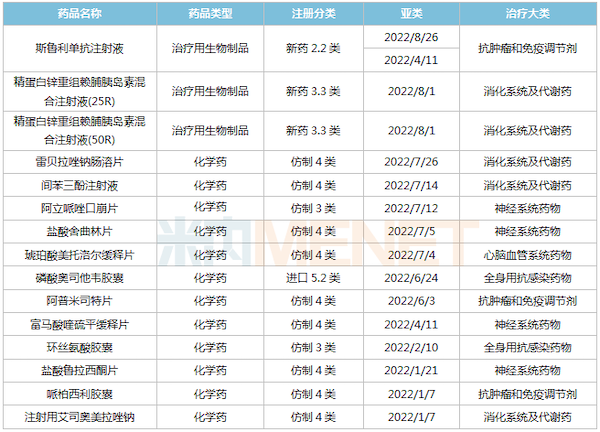
2022年至今,复星医药首款生物1类新药——斯鲁利单抗注射液获批上市,用于治疗微卫星高度不稳定(MSI-H)实体瘤;此外,利妥昔单抗注射液创新适应症——类风湿关节炎(RA)获批上市,该品种2022H1实现收入8.19亿元。此外,多个仿制药获批生产并视同过评,目前复星医药过评/视同过评品种已超过50个。
2022年至今复星医药国内报产的部分品种
来源:米内网MED2.0中国药品审评数据库
申报方面,斯鲁利单抗新适应症报产,联合化疗(卡铂和依托泊苷)一线治疗广泛期小细胞肺癌(ES-SCLC);2款胰岛素首次报产,目前国内仅甘李药业及礼来拥有精蛋白锌重组赖脯胰岛素混合注射液(25R)生产批文,而精蛋白锌重组赖脯胰岛素混合注射液(50R)暂无国产品种获批。
04
中生制药:创新药大卖35亿元,2款1类新药首次报产
2022上半年中国生物制药研发开支21.92亿元,比去年同期增长16.51%,占销售收入比重14.43%。创新药已成为其业绩增长的重要驱动力,报告期内收入34.9亿元,比去年同期增长14.2%,并有望在2023年突破100亿大关。
截至6月30日,中国生物制药累计有临床批件、正在进行临床试验和申报生产的在研产品共418件,其中肝病用药29件、抗肿瘤用药230件、呼吸系统用药31件、內分泌用药9件、心脑血管用药16件、外科3件、镇痛4件、其它类用药96件。
2022年至今中国生物制药获批上市品种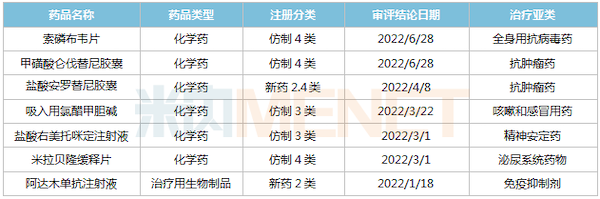
来源:米内网MED2.0中国药品审评数据库
2022年至今,中国生物制药有2款新药(含新适应症)获批上市,其中安罗替尼获批第5个适应症——分化型甲状腺癌,该产品2021年在中国三大终端6大市场(统计范围详见本文末)的销售额达45亿元。此外,5个仿制药获批生产并视同过评,其中吸入用氯醋甲胆碱为首仿。截至目前,中国生物制药过评/视同过评品种已超过80个。
2022年至今中国生物制药报产品种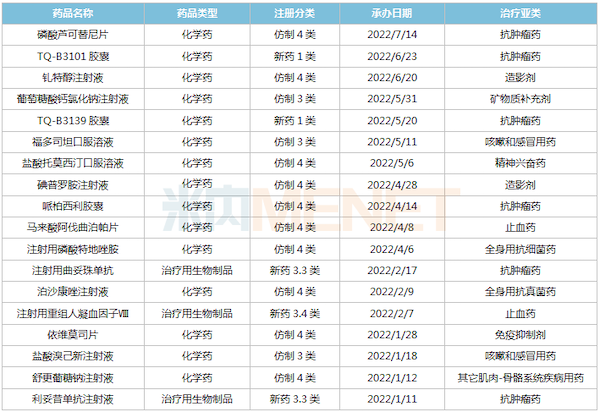
来源:米内网MED2.0中国药品审评数据库
首次提交上市申请的2款1类新药TQ-B3101、TQ-B3139均为多靶点酪氨酸激酶抑制剂,前者核心发力点在ROS1阳性实体瘤,后者则偏重于对ALK阳性患者群体的治疗,两者同线推进。除了上述两款产品,目前中国生物制药报产在审的1类新药还有长效G-CSF艾贝格司亭α,预计2023年上半年获批。
2款生物类似药首次报产,2021年中国三大终端6大市场曲妥珠单抗、利妥昔单抗销售规模分别超过60亿元、50亿元;此外,13个仿制药以新注册分类报产,其中磷酸芦可替尼片、碘普罗胺注射液、依维莫司片、马来酸阿伐曲泊帕片等暂无首仿(含剂型首仿)获批。
资料来源:米内网数据库、公司公告等
注:米内网《中国三大终端6大市场竞争格局》,统计范围是:城市公立医院和县级公立医院、城市社区中心和乡镇卫生院、城市实体药店和网上药店,不含民营医院、私人诊所、村卫生室,不含县乡村药店;上述销售额以产品在终端的平均零售价计算。数据统计截至8月31日,如有疏漏,欢迎指正。