▎Armstrong
2022年11月30日,FDA批准辉凌制药的RBX2660上市,用于降低18岁以上成年人艰难梭菌感染(CDI)后的复发,商品名为Rebyota,这也是FDA批准的首款粪便微生物疗法。

FDA CBER主任Peter Marks博士认为,“Rebyota的获批对于艰难梭菌感染患者的治疗是一个进步,因为复发影响患者的生存质量,同时也可能危及生命。作为FDA批准的首款粪便微生物疗法,今天的批准标志着一个重要的里程碑,因为它为阻止CDI复发提供了额外的选择”。

艰难梭菌感染在美国每年有50万病例,15000-30000人因此死亡。艰难梭菌感染经常成为复发恶性循环的开始,给患者和医疗系统造成沉重负担。据估计,高达35%的CDI病例在初次诊断后会复发,复发者发生进一步感染的风险显著升高。首次复发后,高达65%的患者可能会再次复发。

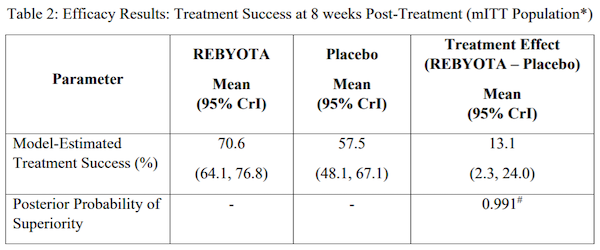
RBX2660的BLA临床数据包含6项临床试验,共1061位参与者,其中有978位接受RBX2660的治疗。在8周的治疗中,RBX2660与安慰剂组分别有70.6%与57.5%的患者展现治疗效果,复发率降低13.1%。
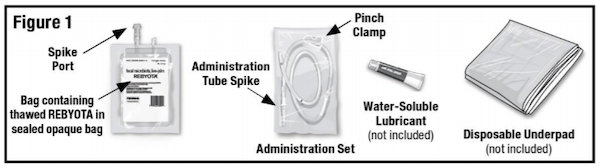
Rebyota为单次给药,体积为150ml,通过直肠给药。Rebyota的获批标志着微生态疗法的里程碑,期待更多微生物疗法的临床进展。