01
介绍
02
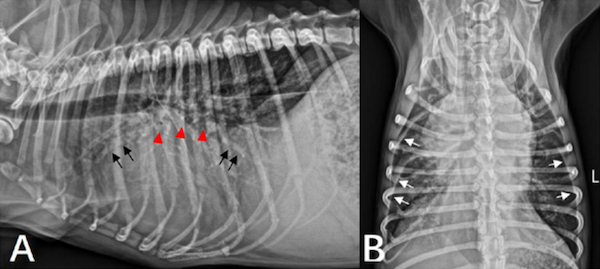
病例信息

Ⅱ导联下的心电图(50mm/s、10mm/mv)显示:QRS波之前无可辨识的P波,且R-R间期不规则,符合房颤的特征;
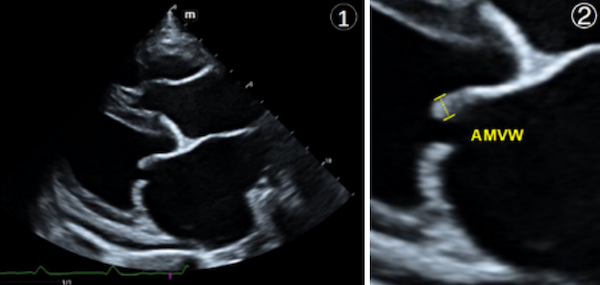

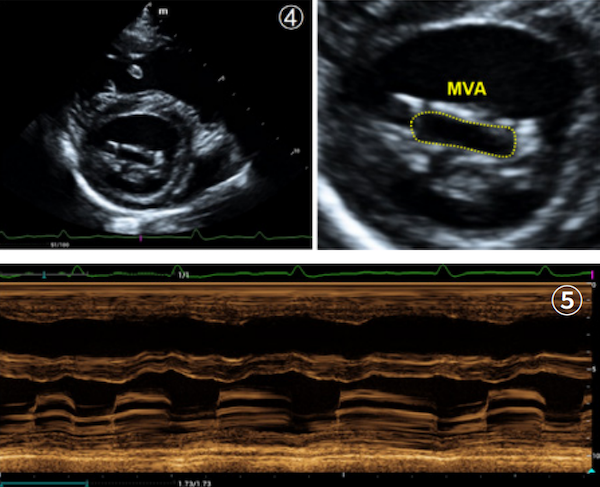
 为了尽可能使血流方向与取样线保持平行,三尖瓣逆流的血流频谱在左头侧右心流入路切面下获得【图⑦】,连续波多普勒CW测得三尖瓣逆流最高速度TR-Vmax = 2.85m/s,依据简化的伯努利方程(△P = 4×V2 m/s)换算收缩期右心室右心房压力差TRPG = 32.5mmHg。左侧心尖五腔切面下经由彩色多普勒模式可观察到舒张期主动脉瓣逆流【图⑧】,连续波多普勒CW模式测得舒张早期流速AR-Vmax = 2.9m/s,舒张末期速度AR-Ved = 1.7m/s,压力减半时间AR-PHT = 285ms;
为了尽可能使血流方向与取样线保持平行,三尖瓣逆流的血流频谱在左头侧右心流入路切面下获得【图⑦】,连续波多普勒CW测得三尖瓣逆流最高速度TR-Vmax = 2.85m/s,依据简化的伯努利方程(△P = 4×V2 m/s)换算收缩期右心室右心房压力差TRPG = 32.5mmHg。左侧心尖五腔切面下经由彩色多普勒模式可观察到舒张期主动脉瓣逆流【图⑧】,连续波多普勒CW模式测得舒张早期流速AR-Vmax = 2.9m/s,舒张末期速度AR-Ved = 1.7m/s,压力减半时间AR-PHT = 285ms;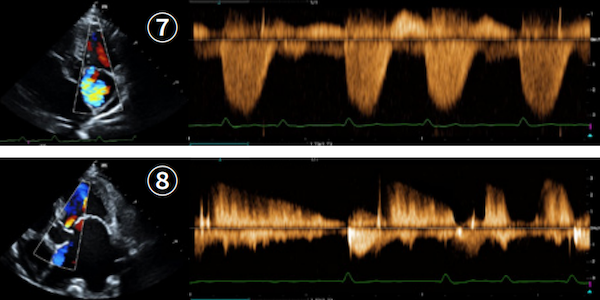
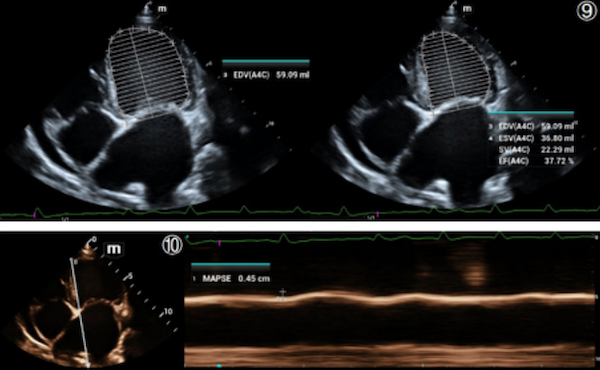
03
诊断与治疗
04
结果与随访
05
讨论
来源:《东西部兽医》杂志
作者:漆鑫