近日,中国农业科学院哈尔滨兽医研究所揭示了弓形虫靶向顶环囊泡运输以及膜蛋白外泌的分子机制,为新型抗弓形虫药物的设计和筛选提供了新策略。相关研究成果发表在《公共科学图书馆-病原体(PLoS Pathogens)》杂志。
弓形虫病(Toxoplasmosis)是一种重要的人兽共患寄生虫病。弓形虫病对胎儿和具有免疫缺陷的人或动物能够造成严重甚至是致命的伤害。外泌是细胞中活跃的生理过程,SNAREs蛋白是介导外泌囊泡与靶膜融合的关键蛋白。在哺乳动物细胞中,SNARE蛋白Stx1和SNAP25家族蛋白介导外泌囊泡与质膜的融合。然而,在弓形虫中只存在一个SNAP25家族蛋白(TgSNAP29)。该团队的前期研究发现,TgSNAP29参与顶质体的蛋白转运过程。目前,介导弓形虫外泌过程的相关蛋白以及相关分子机制尚不清楚。
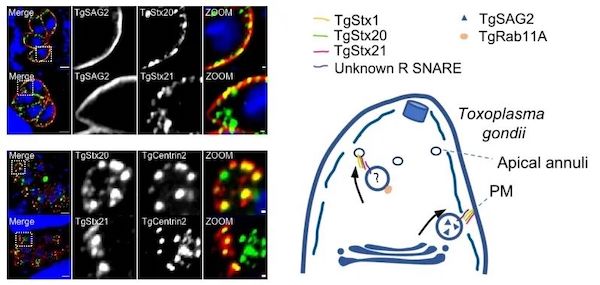
本研究发现了定位在弓形虫顶环结构及质膜上的SNARE蛋白TgStx20、TgStx21与保守的TgStx1相互作用。利用AID条件性敲除系统,证明该复合物介导TgRab11A参与的靶向顶环的囊泡运输以及蛋白外泌过程。TgStx20和TgStx21是首次发现的定位在顶环结构的膜蛋白。顶环结构上存在SNARE蛋白也证明了顶环不可能是先前认为的孔状结构,而可能是封闭膜结构的一部分或者构成一种封闭的区室。
该研究得到国家自然科学基金项目(31872459)资助。
原文及链接:
“An unconventional SNARE complex mediates exocytosis at the plasma membrane and vesicular fusion at the apical annuli in Toxoplasma gondi i ”https://doi.org/10.1371/journal.ppat.1011288