导语 .
深入了解癌症免疫治疗的机制并转化为治疗策略,可以使有限治疗方法的患者得以长期生存。目前,已经重点开发治疗诊断方法来鉴定受益于ICB治疗的患者和增强ICB治疗反应和消除毒性。前面两篇文章已经介绍了ICB治疗原理,目前发现的免疫检查点以及影响ICB治疗的因素,本篇文章将介绍通对ICB耐药的认识,发展出克服耐药性并促进对ICB的反应几种治疗策略。
促进免疫反应和克服耐药性的治疗策略
ICB的积极临床响应与肿瘤浸润性淋巴细胞(TILs)增加、细胞毒性T淋巴细胞(CTL)活化增强,辅助性T细胞1 (TH1细胞)数量增加,调节性T细胞(Treg细胞)数量减少相关。积极的免疫应答还可能由癌细胞的免疫原性驱动。
基于对ICB耐药的认识,近些年发展出几种治疗策略来克服这些机制并促进对ICB的反应。
01
调节表观遗传状态
在低免疫原性和低抗原呈递的肿瘤中,可通过表观遗传调节来减轻对ICBs的耐药性。DNA甲基转移酶抑制剂已被证明可逆转MHC-I的表观遗传抑制,因而促进了抗原呈递、免疫原性和肿瘤免疫靶向。临床前模型中组蛋白去乙酰化酶(HDAC)抑制剂与DNA甲基转移酶抑制剂联用也导致抗肿瘤免疫应答增加,其与ICB联合的临床疗效正在评估。
02
信号调节剂
靶向信号通路有望成为改善ICB应答的潜在策略。编码关键原癌基因和抑癌基因(如MYC、NOTCH1和TP53)的基因突变对肿瘤内免疫细胞浸润有影响;靶向KRAS信号通路的MEK和CDK4/6联合抑制导致了血管重塑,使肿瘤对检查点阻断敏感;靶向BRAF激酶的抑制剂联合抗PD1治疗交叉激活树突状细胞,在2期临床试验中使PFS延长。
03
细胞因子
细胞因子也影响T细胞的转运。来自小鼠模型的证据表明,局部递送IL-12可以恢复T细胞的募集和归巢。研究发现,IL-12可通过重编程免疫抑制性髓系细胞和/或抑制Treg细胞功能改善TME内的免疫抑制。此外,IL-12可诱导肿瘤内产生趋化T细胞的趋化因子,如CXCL9、CXCL10和CXCL11(均为CXCR3配体)。应用IL-7和检查点阻断是另一种可行策略,可能逆转TME内耗竭T细胞的效应功能(图1)。在临床前模型中,抗PD-1和抗CTLA-4联合治疗的疗效依赖于T细胞中的IL-7和IFNγ信号。
细胞因子可增加TILs的丰度以增强对ICBs的应答,然而细胞因子治疗常与严重毒性相关。这些并发症促使努力重新设计下一代细胞因子,并且在临床前研究中显示出与ICB联合使用的有益效果。
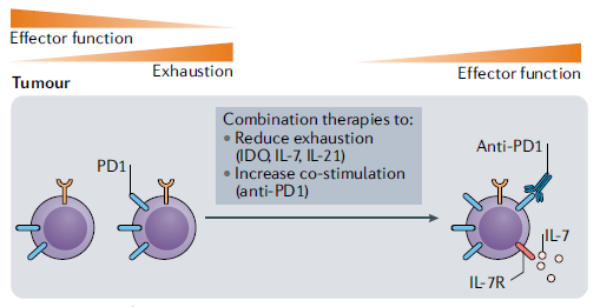
图1 提高抗肿瘤T细胞应答有效性的治疗选择
04
抗血管生成药物
PD-1、PD-L1、PD-L2或CTLA-4阻断剂,联合靶向VEGF或VEGFR的治疗方案已在一些肿瘤中获批使用。抗VEGF治疗可能挽救癌症患者的树突状细胞功能,可使微血管正常化从而增强T细胞向实体瘤的浸润。这一联合治疗可上调内皮黏附分子,并增加促炎因子(TNF、IL-1α、IL-1β和CXCL10)的产生,这些因子联合起来支持T细胞浸润至TME。
数项临床试验评估了抗血管生成治疗联合ICB的益处,与单独ICB相比,联合治疗时肿瘤中免疫细胞浸润增加,结局改善。例如,贝伐珠单抗(抗血管生成药)联合阿替利木单抗(PD-L1抗体)已被美国FDA批准用于未接受过全身治疗的不可切除或转移性肝细胞癌患者。
05
化疗和放疗
化疗和放疗的免疫调节作用已经作为提高ICB应答的另一重要手段,这种联合治疗策略已经应用在不可切除的非小细胞肺癌(NSCLC)患者和三阴性乳腺癌(TNBC)患者中。其中抗PD-L1抗体联合化疗被证明可显著改善总生存期。放疗可通过多种机制促进T细胞浸润到肿瘤中,并通过上调黏附分子直接促进T细胞的跨内皮迁移。这些治疗模式促进T细胞募集到肿瘤部位,并导致干扰素-γ (IFNγ)诱导的CXCR3配体CXCL9和CXCL10水平升高,补充了检查点疗法的作用。TNBC是一种具有“冷”肿瘤微环境的癌症类型,可以通过趋化因子调节疗法将其转化为“热”肿瘤,使其为后续抗PD-1治疗做最佳准备。
06
其他策略
肠道和肿瘤微生物组、应激和饮食对ICB的应答中发挥的作用受到研究者关注,为新兴辅助疗法奠定了基础。更好地理解这些因素的潜在机制,以及发现和验证可操作的靶点,是开发和成功应用这些新兴策略的先决条件。
肿瘤治疗领域中ICB的发现及成功应用为临床癌症患者的治疗提供了前所未有的机遇,使很多癌症患者获得了长期生存的福音。然而,在所有接受ICB治疗的患者中,具有临床获益的患者数量仍然有限。因此,深入了解其耐药的机制十分重要,目前的主要研究方向包括肿瘤遗传学方向(肿瘤细胞自身),以及肿瘤细胞赖以生存的微环境(免疫和非免疫成分)。这虽然是两个不同的角度,但它们之间的联系是十分紧密的,只有联合这两个方向的研究发现,才能更有益于我们全面认识肿瘤。
总的来说,目前的研究结果提示未来成功的治疗将集中在两个关键因素:促进TME中的T细胞归巢从而阻止T细胞功能障碍,及促进TME的炎症免疫微环境的形成。此外,目前来看组合治疗策略是更有效的,通过组合其它治疗手段,可以很大程度上改善T细胞归巢失灵、防止T细胞功能耗竭,还可以通过调节代谢和补充细胞因子等策略达到最佳效果。未来的研究需要了解协同作用的机制,以解决ICB的局限性。
参考文献:
[1] Morad, Golnaz et al. “Hallmarks of response, resistance, and toxicity to immune checkpoint blockade.” Cell vol. 184,21 (2021): 5309-5337. doi:10.1016/j.cell.2021.09.020
[2] Kubli, Shawn P et al. “Beyond immune checkpoint blockade: emerging immunological strategies.” Nature reviews. Drug discovery vol. 20,12 (2021): 899-919. doi:10.1038/s41573-021-00155-y
向上滑动阅览
寻因单细胞免疫组产品

固有免疫系统:病原感染/肿瘤监控的第一道防线,巡逻示警的巨噬细胞、专职杀戮的中性粒细胞、定点清除的NK细胞,共同组成这一套快速响应机制;
适应性免疫系统:又名抗原特异性免疫,在固有免疫细胞们顶住第一波攻击后,DC等抗原呈递细胞(APCs)将肿瘤/病原特异性抗原物质传递给T细胞和B细胞,由TCR/BCR精准识别,抗原专一性T/B细胞大量增殖并激活,投入战场成为针对指定肿瘤细胞和病原微生物的大杀器,终结整场战斗。它们之间的相互协作、信号传递和功能转换,对于我们的疾病和健康,有着至关重要的意义。
寻因单细胞免疫组库产品,立足寻因生物卓越的研发创新能力和品控工艺水平,致力于提供行业精准数据产出和全流程技术服务,助力免疫细胞的分化、发育和免疫识别等功能研究,在肿瘤微环境、细胞免疫治疗、感染性疾病、自身免疫性疾病、过敏性疾病、移植和免疫重建、疫苗/抗体研究等领域具有广泛的应用前景。以我所专,助您所研。
关于寻因生物

北京寻因生物科技有限公司(简称寻因生物)成立于2018年,秉承“用技术温暖生命,预见未来”的企业愿景,致力于全球单细胞市场标准普世化发展,推动单细胞技术在早筛、临床、药研等应用方向的深耕落地,为全球科学家、技术公司及药企工业等客户提供可信赖的高品质单细胞技术服务及实验室建设解决方案。
寻因生物拥有完全自主知识产权的SeekOne®微孔+油包水高通量单细胞双建库平台、单细胞数据库和云数据分析平台、单细胞样本解离平台和围绕多种特殊类型样本及以单细胞转录组为核心的多组学技术解决方案,覆盖单细胞科研全周期全链条的服务。现已与700+客户建立科研合作关系,在北京、上海、广州、成都、武汉、沈阳等地设立地方实验室。同时,已取得80余项发明专利、实用新型专利申请,10余项软著授权。已获得涵盖质量、环境安全、职业健康和信息安全的五项管理体系认证证书,管理系统达到国际标准,有能力持续、稳定地提供高标准、高质量的产品和服务。