来源:小柯生命
北京时间2024年5月22日23时,湖南农业大学园艺学院邹学校院士团队远方团队、刘峰团队以及美国杜克大学裴真明团队在Nature上发表了题为“Osmosensor-mediated control of Ca2+ spiking in pollen germination”的文章。
该研究通过大肠杆菌表达体系筛选了植物OSCA渗透感受器家族,并获得了低渗响应离子通道OSCA2.1,进而发现了OSCA2.1和OSCA2.2在花粉萌发中的关键作用,阐明了渗透感受器依赖的花粉萌发过程中钙震荡是胞外水分多少的第二信使以及其调控机制。
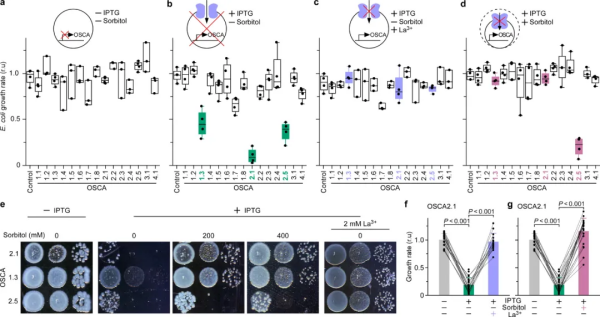
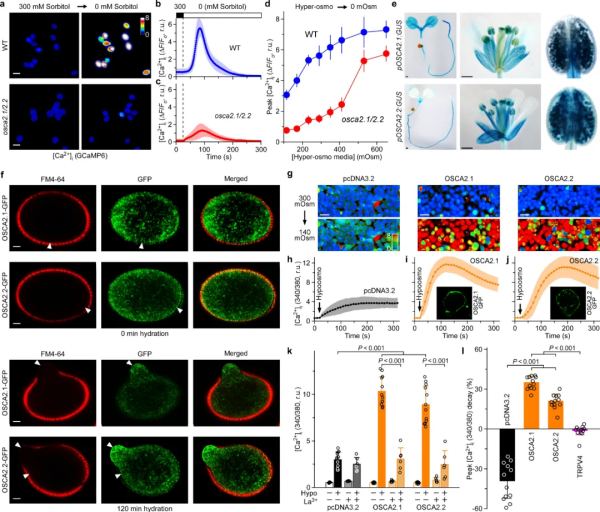
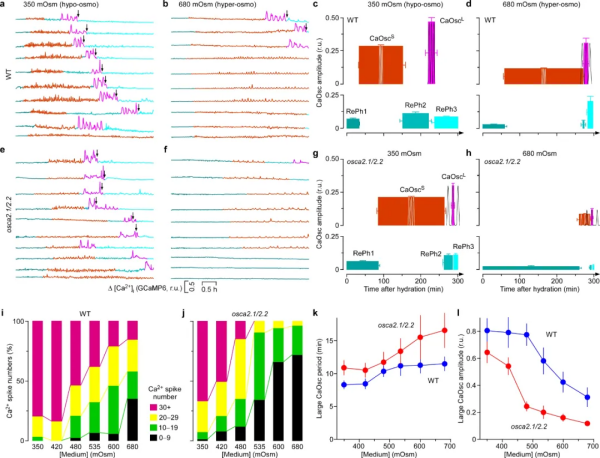
随着全球气候变暖,缺水对植被和农作物的影响会越来越严重。与所有生物体一样,陆生植物必须监测其环境中的可利用水的多少来调控生长和发育。陆生植物从水生祖先进化而来,成功克服了缺水和水分波动这两个看似难以逾越的障碍,适应了陆地环境。当细胞外空间中的水供应多了,细胞可以吸水,胞外渗透压相对于细胞溶质溶液的渗透压较低的时候,低渗感受器可以感受这个低渗信号并将其转化为细胞内的第二信使,如钙信号,启动下游的生理生化反应。然而,植物中的低渗感受器从未被发现。30多年前,低渗透压诱导的胞质钙增加(HOSCA)已经被推测为低渗透压感受机制,但其分子基础仍然未知。在本研究中,科研团队在模式植物拟南芥中发现了首个真正的细胞表面低渗透感受器离子通道,并发现了花粉钙信号是通过低渗透感受器直接受水调控的,即花粉钙信号是响应水分的第二信使。这是一个全新的信号通路,有可能成为水调控植物细胞生长的一个重要分子机理,进而有利于提升农作物的抗逆性和产量。图1. E. coli功能表达系统筛选到低渗感受器OSCA2.1科研人员在将植物渗透感受器-离子通道基因家族成员(OSCAs)【1】克隆到大肠杆菌载体的过程中,发现由于离子通道蛋白毒性的原因导致一些OSCA家族成员很难被克隆,有幸研究人员发现降低培养基中的钠离子的含量和增加渗透压解决了克隆问题(图1)。通过进一步优化,在大肠杆菌中开发了低渗响应离子通道的功能表达筛选体系,并分离出低渗感受器OSCA2.1,是15个成员的OSCA家族中为数不多的能够感受低渗的。图2. OSCA2.1 和 OSCA2.2 在花粉粒和 HEK293 细胞中行使低渗激活的细胞质膜钙离子通道功能本研究筛选了单敲除和多敲除OSCA突变体,并观察到osca2.1/2.2双敲除突变体在花粉萌发和低渗诱导的胞质钙增加(HOSCA)方面受到抑制(图2)。为了进一步分析OSCA2.1/2.2分子机制和生理功能,需要明确它们的表达模式和亚细胞定位。OSCA2.1 和 OSCA2.2 在整个幼苗、花和花粉中表达。OSCA2.1/2.2定位在花粉粒、花粉管的细胞膜上,在异源表达中也定位在哺乳动物细胞膜上。osca2.1/2.2突变体的花粉粒不能像野生型一样响应低渗诱导的胞质钙离子浓度增加,说明OSCA2.1 和 OSCA2.2有感受低渗的功能。渗透胁迫处理后,表达OSCA2.1或2.2的HEK293细胞中胞质钙离子浓度增加。这些数据证明了OSCA2.1和OSCA2.2在植物和HEK293细胞中形成低渗透调控的钙离子通道,是植物低渗感受器。为了系统地描述、定义、统计和量化钙振荡的生物学特点,研究人员记录并揭示了以前未有报道的花粉粒萌发前钙信号模式(图3):第一个静止阶段 (RePh1),随后是小幅度的钙振荡 (CaOscS),然后是第二个静止阶段 (RePh2),随后是导致花粉管突出的大幅胞质钙振荡 (CaOscL),最后是第三个静止阶段 (RePh3)。数十个CaOscS均匀地出现在细胞质中,之后CaOscL逐渐向萌发孔附近富集,最终引发花粉管突起(萌发起始)。降低培养基渗透压会增强花粉钙振荡,这一现象是由OSCA2.1/2.2介导,是花粉粒萌发所必需的。OSCA2.1/2.2离子通道将花粉粒外(胞外)可利用的水分信号转化为花粉粒中(胞内)的钙信号,该离子通道被证实是科学家探索已久,但从未被发现的植物低渗感受器。图3. 通过降低水势来诱导花粉粒钙振荡(模拟复水过程)在 osca2.1/2.2 突变体中被破坏水是细胞扩展最重要的驱动力,“多水(胞外)®低渗感受器(细胞膜)®钙信号(胞内)”途径除了揭示生殖细胞花粉粒萌发机理外,也对理解营养组织中细胞扩展机制具有重要意义。渗透感受器OSCA基因家族1起源于原生生物(protists)的进化过程,可能它们在维持细胞形状和彭压方面发挥作用。此外,植物OSCA基因家族的扩张和进化伴随着植物从水到陆地的转变,在植物响应水分变化中发挥着重要作用。该研究成果鉴定了植物低渗感受器OSCA2.1和OSCA2.2,环境水分信号转化为细胞内的钙信号,进而调控下游的生理生化反应,系统解析了植物如何感受环境有效水分的分子机制。近年来,随着全球气候变化,极端天气(干旱和洪涝)灾害发生频率及危害程度逐年增加。农作物抗旱和耐涝机理的复杂性,利用传统育种方法提高植物的抗旱性困难重重,迄今为止,还未能找到可以有效提高农作物干旱和涝胁迫能力的方法。本研究成果对研究农作物如何利用有效水分,增强水胁迫抗性(抗旱和耐涝)提供了重要的基因资源;也为揭示植物适应全球环境变化的生理生态效应及分子机制提供重要的理论依据,对提升我国粮食和生态安全具有重大战略意义。这是湖南农业大学建校120年首次作为第一完成单位、第一作者、以及通讯作者在国际顶级综合性期刊正刊上发表研究性论文,其中园艺学院邹学校院士团队裴宋雨博士为第一作者,远方教授和刘峰教授以及美国杜克大学裴真明教授为并列通讯作者【2】。该Nature文章中植物低渗感受器的发现是远方等相继发现了植物高渗干旱感受器【1】,盐感受器【3】,以及双氧水感受器【4】之后的又一重大突破。该研究获得国家“十四五”重点研发计划“农业生物重要性状形成与环境适应性基础研究”重点专项“粮食作物环境感受受体的鉴定及其响应机制(基础类研究)”资助。https://www.nature.com/articles/s41586-024-07445-61. Yuan, F. et al. OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis. Nature 514, 367-371 (2014).2. Pei, S. et al. Osmosensor-mediated control of Ca2+ spiking in pollen germination. Nature (2024).3. Jiang, Z. et al. Plant cell-surface GIPC sphingolipids sense salt to trigger Ca2+ influx. Nature 572, 341-346 (2019).4. Wu, F. H. et al. Hydrogen peroxide sensor HPCA1 is an LRR receptor kinase in Arabidopsis. Nature 578, 577-581 (2020).