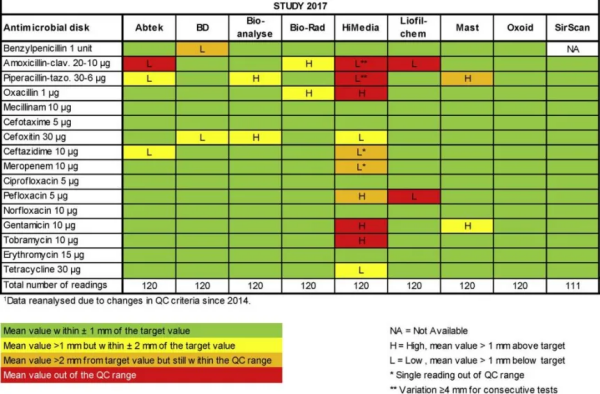
来源:元医动物医学实验室
引言
1928年,亚历山大·弗莱明教授(Dr. Alexander Fleming)发现了青霉素,随后提纯并合成了这种化合物,这是人类历史上对抗传染病的里程碑。在接下来的几十年里,制药公司开发了大量的抗微生物药物,因此,在20世纪80年代初,细菌性疾病似乎几乎消失,也使动物健康和福祉得到实质性改善。然而,从那时起,生物医学界注意到不断出现新菌种,更重要的是,出现了已知病原体的耐药菌株,使它们几乎无法治疗。 细菌已经进化了30多亿年,是简单而有弹性的微生物。当它们的生存环境和条件不再有利时,例如抗生素出现时,它们能够改变自己,因此发展出了抵抗抗微生物化合物的能力,以减少其他物种的竞争。随着“抗生素时代”的开始,细菌受到了一种选择压力,这种压力有利于那些具有遗传能力来抵消这种压力的微生物生存。因此,可以说抗生素耐药性(AMR)是一种自然现象,因为这是它们能够生存的先决条件。正如弗莱明教授在诺贝尔奖致辞中敬告的那样,“使用抗生素可以,也必将导致耐药性”。 图1.抗生素耐药机制(图源onlinepublichealth.gwu.edu) 在全球范围内,抗生素耐药性已成为主要公共卫生战略问题之一,俨然也已成为兽医学中的一个重大痛点。因为动物源性微生物的高耐药率报告数量相当高,且动物中的AMR现象比人类复杂得多。耐抗生素细菌 (ARBs)和抗生素抗性基因 (ARGs)以及多重耐药菌(MDRO)已经出现并在犬猫间传播(表1),甚至在未接受抗生素治疗的动物粪便中检测到大量ARGs,包括关键抗生素(CIAs)(如喹诺酮类和碳青霉烯类),因此我们需要更加谨慎和有意识地使用抗生素。 AMR的威胁主要是由于抗生素的滥用和误用,尤其是在动物(食用动物、伴侣动物等)中的使用,大大促进了耐药菌的出现和传播。已证实细菌可通过垂直(向细菌后代)和水平(向其他细菌或物种)传播ARGs。越来越多研究认为伴侣动物是耐药菌发展、携带和传播的重要贡献者。兽医必须意识到,正确的诊断以及在治疗前进行抗生素药敏试验是使动物尽快恢复健康和避免AMR的有效方式。 是否应该进行细菌培养与药敏试验? 临床兽医的第一个问题往往是治疗前是否需要进行细菌培养与药敏试验,而答案通常是“不”。我们可以轻易从各种渠道得到用药指南,且经验性治疗可能经常有效。但经验性治疗应基于感染不复杂、且感染是由“野生型细菌”引起为前提。“野生型细菌”是指那些没有获得性和突变耐药机制的细菌,而“非野生型细菌”是指具有获得性或突变耐药机制的细菌。 动物(食用动物、伴侣动物和外来动物)中最常用的抗生素类别是喹诺酮类(尤其是氟喹诺酮类)、氨基霉素单用或与增强剂联合使用、第一代和第二代头孢菌素、四环素、磺胺类单用或与增强剂联合使用,以及第三代和第四代头孢菌素、大环内酯类和糖肽类。其中大环内酯类药物、氟喹诺酮类药物、第三代和第四代头孢菌素以及糖肽类抗菌药物被归类为最高优先级的重要抗生素(HPCIAs)。 图2. 应在用药前通过药敏试验找到最适配的抗生素 (图源www.gov.uk) 国际兽疫局(OIE)于2022年发布的《陆生动物守则》是兽药中负责任和谨慎使用抗微生物药物的最新指南。它确定了主管当局和利益相关者在兽药(即抗生素)从授权到管理到动物的所有过程中的各自责任,其中就包括尽可能根据抗生素药敏试验结果来选用抗生素。减少对动物使用抗生素,需要兽医非常重视抗生素的处方,以确保其被负责且谨慎使用。兽医可以根据定义的标准开处方或配发抗生素(表2)。 应何时进行细菌培养与药敏试验? 如果临床医生怀疑感染可能是由对经验选择药物具有耐药性的细菌引起的,则需要进行细菌培养和药敏试验。如果没有药敏试验,对这些菌株的治疗效果是高度不可预测的。最有可能耐药的细菌是铜绿假单胞菌、大肠杆菌、肺炎克雷伯菌、肠杆菌、肠球菌和假中间葡萄球菌。 如果最初的经验性治疗不成功,或者怀疑存在耐药菌株,建议进行药敏试验。该测试对于(1)确认细菌病原体的存在,(2)确定细菌种类以便了解毒性机制,(3)指导治疗,(4)监测结果(治疗的成功或失败)很重要。 在一项为期十年(2012 - 2021年)的中国东北地区犬猫产β-内酰胺酶大肠杆菌耐药性及流行病学分析中,调查了中国犬猫中ESBL大肠杆菌耐药表型和ARGs的流行情况。研究显示大肠杆菌是肠道菌群中最常见的微生物之一,不断受到抗生素选择压力的影响。作者发现,患具有多种抗生素耐药模式的大肠杆菌高达86.64%(高于其他研究的结果)。此外,该研究还发现ESBL大肠杆菌在猫中的患病率高于犬,这与其他研究结果不同。假设这可能是由于猫比犬使用更多的第三代头孢菌素。猫不太可能通过口服或食物给药,这导致猫更多选用注射制剂。从犬猫身上分离的大肠杆菌与人类身上分离出的高度相似,增加了耐药菌株在物种间转移的可能性。 图3. 据统计,畜牧业抗生素的使用占欧美药物消费量的75%以上 (图源bma.org.uk) 另一项美国的报道中,发现从美国不同地区收集的大肠杆菌分离株的耐药发生率也很高,且多重耐药(MDR)分离株占耐药株的56%,其中一半以上对阿莫西林、阿莫西林/克拉维酸钾和恩诺沙星耐药。抗生素治疗史是导致耐甲氧西林葡萄球菌以及其他耐药机制细菌的已知风险因素。氟喹诺酮类药物的活性尤其难以预测,尤其是患宠以前曾用过这类药物。有氟喹诺酮类用药史的犬可能会产生大肠杆菌耐药菌株,这种菌株在药物治疗停止后还会长时间存在。 图4. 微生物检验流程 在上一篇《元医微生物平台升级MIC药敏法-助力精准评估抗生素敏感性》这一文章中,已向大家详细介绍过药敏试验的两种主要方式和优势,详情可戳:(文章链接)。这期我们主要讨论关于如何解读药敏试验报告。 图5. 九家不同厂家药敏纸片的纸片扩散结果与 EUCAST 质量控制目标和范围对比。 注:欧洲抗菌剂药敏试验委员会 (EUCAST) 根据QC目标值和范围对九家生产商的16种抗菌剂的药敏纸片进行了药敏试验。 在该研究中,只有 Oxoid(赛默飞世尔科技品牌)纸片在所有16种抗菌剂的试验中平均值都在目标值范围内。Oxoid为杭州元医实验室选用品牌。 如何解读药敏试验报告? 耐药和敏感性是通过比较微生物的MIC和药物折点来判定的,该折点是由美国国家临床实验室标准委员会(NCCLS)建立。在实验室确定MIC后,它可以使用CLSI中的“S I R”分类(S-敏感;I-中介;R-耐药)。在实践中,如果细菌的MIC为敏感,那么治愈的可能性要大于MIC耐药;如果MIC为耐药,则更有可能由于特定的耐药机制或患者体内药物浓度不足而导致细菌治疗失败。然而,即使为MIC耐药的药物,在免疫系统正常的患宠中也可能根除感染,但体外试验结果并不是绝对的。 预测细菌是否对治疗有反应通常被称为“90/60法则”。90/60法则来源于观察经验,但这些观察结果仅适用于由单一细菌引起感染的免疫功能正常的患者,此时药物有望充分渗透到感染部位。而许多患者有多微生物感染,需要进行多种抗生素治疗,有可能影响药物分布(例如,蛋白质结合改变)。口服抗生素吸收不足、免疫功能受损、感染部位渗透不良等都可能影响治疗效果。 中介旨在作为敏感菌株和耐药菌株之间的缓冲区。如果MIC值处于中介水平,则不建议以常用标准剂量用药治疗,因为很可能不足以治愈。然而,当药物在某些部位集中(例如在尿液中,或作为局部治疗的结果)或剂量高于标签上列出的最低有效剂量时,则有可能治疗成功。一些抗生素的处方指南允许在药敏试验结果为中介时增加给药剂量,例如氟喹诺酮类药物。在这些情况下,如果临床医生能够安全地增加剂量,更高的药物浓度则有可能治愈。(例如,在使用处于中介水平的恩诺沙星治疗犬时,可选用10 - 20mg /kg/d,而不是最低剂量5mg /kg/d。) 图6. 实测MIC值的优点 MIC数据不应单独使用,应将实验室报告中的MIC值与CLSI折点和其他重要信息(如细菌的毒力和药理学)结合起来,应用药代动力学/药效学(PK/PD)方法确定抗生素的正确给药方案,改善患者预后和限制耐药菌出现。 药敏试验能提供组织特异性解释吗? 敏感性解释是基于血浆/血清中药物浓度。没有组织特异性解释可以说明药物在组织间分布的差异。例如,尽管预计许多抗生素会集中在尿液中,这可能对治疗尿路感染有益,但敏感性解释是基于足够的血药浓度。即使尿液中药物浓度很高,也足以根除尿路感染,但感染可累及较深层的黏膜、肾或前列腺。在这些情况下,血药浓度才能预测治疗。 在大多数情况下,临床兽医无需关心是否存在组织特异性敏感性的问题。对于大多数组织,血清或血浆中抗生素蛋白未结合的药物浓度与细胞外间隙(间质液)中的药物浓度相近。因为通常没有阻碍药物从血管室扩散到细胞外组织液的屏障。就大多数药物在大多数组织中的作用而言,没有“穿透性好”和“穿透性差”之分。毛细血管内皮的空隙或微通道足以让药物通过,除非药物受到血液中蛋白质结合的限制。缺乏孔隙或通道的皮肤可能会抑制某些药物的渗透。 如果血浆中药物浓度足够,只要组织有足够的血液供应,药物通常可以到达感染部位。但在治疗血液供应不良或受损的组织时,临床兽医应予以关注,此时药物可能无法顺利扩散到脓肿或肉芽组织中,因为药物渗透依赖于简单的扩散,而感染部位缺乏足够的血液供应。在脓肿中,扩散可能没有物理屏障(即没有不可穿透的膜),但可达到药物浓度较低,且药物浓度的积累可能很慢。 在一些组织中,脂质膜(如毛细血管上的紧密连接)可阻止药物扩散。在这些情况下,药物必须具有足够的脂溶性,或者可被积极地携带穿过膜,以达到组织中。这些组织包括中枢神经系统、眼睛和前列腺。血浆和支气管上皮之间也有屏障(血-支气管屏障),这限制了一些药物在支气管分泌物和气道上皮液中的药物浓度。亲脂性药物可能更容易通过血-支气管屏障扩散并在支气管分泌物中达到有效的药物浓度。 图7.尽可能选用窄谱抗生素(图源www.gov.uk) CLSI敏感性解释有物种特异性吗? 在过去的几年里,兽医诊断实验室不得不严重依赖于CLSI对人类标准的解释。没有足够的兽医特定的解释标准来建立兽药折点。这种情况现在正在改变。在过去的几年中,CLSI极大地扩展了具有兽医特定折点的药物列表。对于伴侣动物,现已为4种获批的氟喹诺酮类药物建立了兽医特异性MIC折点:恩诺沙星、双氧沙星、马波沙星和奥比沙星。庆大霉素、头孢多肟、氨苄西林/阿莫西林、阿莫西林-克拉维酸、第一代头孢菌素(头孢氨苄和头孢唑林)和克林霉素(仅限犬用)也有兽医折点。对葡萄球菌耐药性的解释也有重要的改变。在为伴侣动物使用的其他抗生素建立其他兽医特定的折点之前,我们将继续选用人药折点,如阿米卡星、氯霉素、红霉素、碳青霉烯类(亚胺培南)、青霉素类、磺胺类、强化磺胺类和四环素类。人类和动物之间的药代动力学和病原体敏感性的相似性,因此可以进行推算。 药敏试验的局限 即使使用了适当的标准,药敏试验也不是完美的。前面讨论的90/60法则提醒我们,我们治疗的动物具有不确定的潜在疾病和免疫状态。个体动物在药物代谢动力学、对治疗的反应和免疫状态方面可能有所不同。药敏试验无法准确预测治疗结果的原因有很多。其中包括: 药敏试验假定血浆和组织药物浓度相等。如前所述,药敏试验会高估难以渗透的组织中的抗菌活性,如中枢神经系统、前列腺液、眼睛和呼吸道。另一方面,药敏试验可能低估局部治疗、局部输液和集中在尿液中的抗菌药的活性。 药敏试验低估了浓度低于MIC(亚MIC)时的活性。有些药物在低于最低抑菌浓度时表现出抗菌作用,但在常规药敏试验条件下无法量化。 药敏试验通常不检测抗生素组合,并可能错过潜在的药物协同组合。 药敏试验无法考虑可能影响抗生素活性的局部因素,如脓、低氧张力或组织血供不足。 缺乏兽药解释标准,某些药物的人用标准可能与动物并不等同。 兽医很快就会把治疗无效归因于培养和药敏试验的失败,但实际中治疗失败的原因有很多。在评估治疗无效的患宠时,必须考虑导致抗生素治疗无效的许多因素(见表3)。 04 结语 抗生素是人类和兽医学中最重要的治疗选择之一,但AMR是一个严重的公共卫生问题。如果我们希望能够长期有效利用这些化合物,合理使用便必不可少。准确的诊断和药敏试验是正确治疗的基础。 人与动物之间存在着密切的关系,这种关系植根于这样一个事实:尽管物种不同,但两者都是具有相似生物过程的复杂生物体。我们关注抗生素在动物中的使用,强调负责任和谨慎使用的重要性,以及兽医需要了解可以优化剂量方案的PK/PD方法,即使在重症患者(ICU)中也是如此。 抗生素管理、协调方式和干预措施,不仅侧重于减少抗生素的使用,而且还包括感染控制、临床微生物学、抗生素合理使用和抗生素耐药性监测,以及药物警戒、教育、指南和法规。在这个过程中兽医发挥着关键作用,对人-动物-环境三位一体负有高度责任,应仔细评估其决定的后果,并有责任教育每一个对动物使用抗生素的人(例如,饲养员和宠物主人)。动物医疗应与人类医学共同承担这一重任,并为同一目的(抗击和遏制AMR)而努力。 元医动物医学诊断实验室 微生物平台项目优势 动物病原微生物二级实验室(ABSL-2)备案 采用全自动MIC药敏分析仪,MIC+KB双方法学开展药敏试验 严格遵循CLSI-2023+CLSI-VET01/08/09国际临床微生物试验标准执行 MALDI-TOF微生物质谱法+16S rRNA基因扩增测序法进行微生物鉴定 比色与比浊联合测定,4波长同时检测,定时不间断自动判读,AI智能算法模型。 多中心联合构建的菌株库、数据库和专家系统,数据库实时更新,结果报告更有保障。 自动修正天然耐药和强制耐药的药敏解释,涵盖ESBLs、CRE、MRSA、VRE、PRSP高水平耐药和诱导耐药等临床耐药表型检测。 需氧/厌氧/兼性厌氧菌、酵母菌、皮肤癣菌、血培养多种培养方式 药敏试验涵盖兽用及人用常见抗生素50+,前沿新药10+ 参考文献 [1] Caneschi A, Bardhi A, Barbarossa A, Zaghini A. The Use of Antibiotics and Antimicrobial Resistance in Veterinary Medicine, a Complex Phenomenon: A Narrative Review. Antibiotics. 2023; 12(3):487. [2] Mateu E, Martin M. Why is anti-microbial resistance a veterinary problem as well? J Vet Med B Infect Dis Vet Public Health. 2001 Oct;48(8):569-81. [3] WOAH—World Organization of Animal Health. Terrestrial Code Online Access; WOAH: Paris, France, 2022. [4] Papich MG. Antimicrobials, susceptibility testing, and minimum inhibitory concentrations (MIC) in veterinary infection treatment. Vet Clin North Am Small Anim Pract. 2013 Sep;43(5):1079-89. [5] Singleton DA, Rayner A, Brant B, Smyth S, Noble PM, Radford AD, Pinchbeck GL. A randomised controlled trial to reduce highest priority critically important antimicrobial prescription in companion animals. Nat Commun. 2021 Mar 11;12(1):1593 [6] Rushton J. Anti-microbial Use in Animals: How to Assess the Trade-offs. Zoonoses Public Health. 2015 Apr;62 Suppl 1(Suppl 1):10-21. [7] [1] Clinical and Laboratory Standards Institute. 2018. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically: approved standard. Document M07-A11, Clinical and Laboratory Standards Institute. [8] [2] Clinical and Laboratory Standards Institute. 2019. Performance standards for antimicrobial susceptibility testing: approved standard. Document M100-S29, Clinical and Laboratory Standards Institute. [9] Zhou, Y.; Ji, X.; Liang, B.; Jiang, B.; Li, Y.; Yuan, T.; Zhu, L.; Liu, J.; Guo, X.; Sun, Y. Antimicrobial Resistance and Prevalence of Extended Spectrum β-Lactamase-Producing Escherichia coli from Dogs and Cats in Northeastern China from 2012 to 2021. Antibiotics 2022, 11, 1506.