近日,华中农业大学动科动医学院赵凌教授团队在Cell Reports杂志发表了题为“Lyssavirus matrix protein inhibits NLRP3 inflammasome assembly by binding to NLRP3”的最新研究成果。该研究是团队继揭示丽莎病毒属(Lyssavirus)的M蛋白劫持自噬小体促进出芽的机制(Autophaghy,2024)、诱发神经骨架损伤的机制(mBio,2024),以及与宿主因子TRIM72互作的机制(PLoS Pathogens,2024)等一系列重要研究进展后,发现M蛋白抑制NLRP3炎症小体活化的最新成果,为狂犬病病毒免疫逃逸机制的解析和狂犬病的临床治疗奠定了基础。
狂犬病病毒(RABV)是丽莎病毒属的重要成员之一,是一种典型的嗜神经病毒,其需要从外周的感染部位逆轴突传输至中枢神经系统(CNS),最终在CNS大量复制导致机体发病死亡。RABV在外周感染后将激发机体的先天性免疫反应来对抗病毒感染,因此RABV成功逃逸宿主外周的先天性免疫是其建立感染的第一步,也是最关键的一步。NLRP3炎症小体是先天性免疫的重要组成部分,研究团队通过比较分析发现RABV强毒株能显著抑制外周的树突状细胞(BMDC)中的NLRP3炎症小体活化,进一步研究发现病毒的M蛋白在其中发挥重要作用。
NLRP3炎症小体活化分为两个阶段,第一阶段为启动阶段(Priming stage),第二阶段为激活阶段(Activation stage),研究团队发现M蛋白通过抑制NF-κB通路来抑制其第一阶段,而后进一步通过与NEK-7分子(NLRP3炎症小体激活的关键蛋白)竞争性结合NLRP3分子来抑制其第二阶段。利用分子对接进行互作蛋白结构的模拟,并通过点突变和Co-IP等方法进一步发现M蛋白的第158位丝氨酸在其与NLRP3分子互作中发挥关键作用,而这一位点在丽莎病毒属的病毒中非常保守。最后通过反向遗传操作系统构建和拯救了突变M蛋白158位点(G158S)的重组RABV(rCVS-M-G158S),并在小鼠感染模型中验证了该位点能够通过抑制NLRP3的活化来逃避宿主先天性免疫反应,从而显著提高了RABV入侵CNS的病毒载量,导致死亡率显著升高。本研究揭示了丽莎病毒属的M蛋白抑制NLRP3炎症小体活化的免疫逃逸机制,为狂犬病的临床治疗提供新靶点。
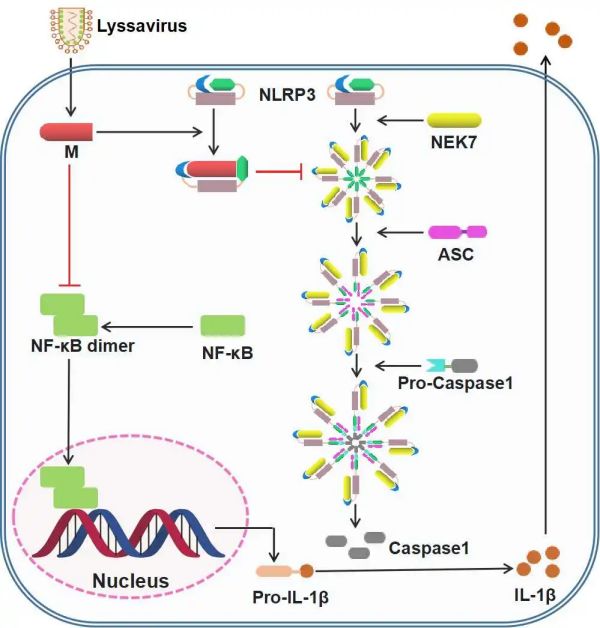
丽莎病毒属M蛋白抑制NLRP3炎症小体活化的分子机制图
华中农业大学教授赵凌、副教授周明为本文的共同通讯作者。华中农业大学博士后隋保坤、赵剑清为本文共同第一作者。该研究获得了国家重点研发计划、国家自然科学基金、中国博士后创新人才支持计划以及博士后面上项目等项目的大力资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/38985668/
来源:华中农业大学