
免疫抑制病毒具有独特对抗宿主免疫防御的感染机制,往往造成传统疫苗策略功效受限。猪繁殖与呼吸综合征病毒PRRSV导致生猪免疫抑制和系统性感染,是当前猪病防控中最重大难题之一。针对PRRSV免疫调控机制和新型防控策略,浙江大学动物科学学院何放课题组开展多年的探索创新。2024年7月,连续在《Autophagy》(IF5=16.8)杂志上在线发表了题为“PRRSV utilizes MALT1-regulated autophagy flux to switch virus spread and reserve”的研究论文,揭示了PRRSV利用宿主MALT1蛋白调节细胞自噬从而帮助病毒感染的机制;并在《Journal of Nanobiotechnology》(IF5=11.4)杂志上发表题为“Nanobody peptide conjugate: a novel CD163 based broad neutralizing strategy against porcine reproductive and respiratory syndrome virus”的应用研究论文,该研究基于靶向PRRSV颗粒的特异性纳米抗体以及靶向PRRSV RBD的中和性CD163受体表位多肽,开发出一种全新形式的抗病毒制剂—纳米抗体-多肽偶联物(NPC)。

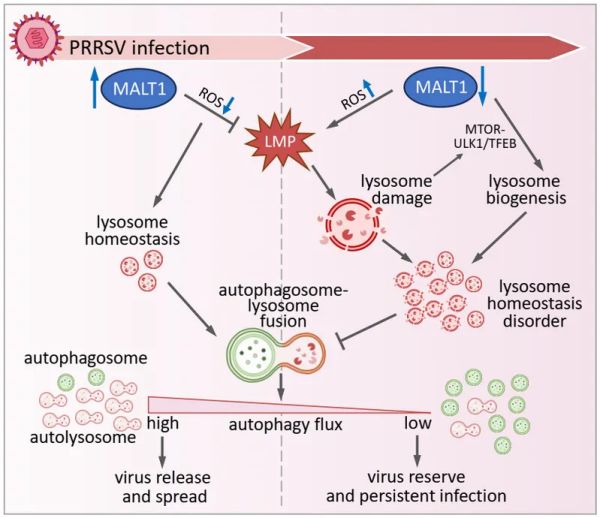
既往研究证明PRRSV体内外感染均激活自噬,而自噬促进PRRSV增殖。然而,PRRSV与自噬的相互调控机制还不完全清楚。实验室前期报道了PRRSV感染动态调控MALT1水平,在拮抗宿主抗病毒RNA酶和维持免疫稳态中发挥重要作用(mBio,2022)。MALT1是一种重要的免疫调节蛋白,其与病原感染的相互调控关系知之甚少。有研究表明MALT1参与mTOR活化和溶酶体稳态等自噬相关过程,但其是否参与PRRSV的自噬调控及其机制还未知。本研究以动态视角分别阐述了PRRSV早期和晚期感染阶段MALT1的动态变化对自噬流的调控作用及其机制,并揭示了MALT1调控的自噬流对不同感染阶段病毒释放和潜伏的意义。研究发现MALT1对于PRRSV诱导的自噬流至关重要,PRRSV感染初期MALT1能够通过消除过量的ROS维持溶酶体稳态和自噬功能,促进自噬流;而感染后期MALT1的显著下调引起ROS的累积,引发溶酶体膜通透(LMP)和溶酶体丰度增加,使得溶酶体稳态失衡,进而抑制自噬融合和自噬流。在此基础上,本研究揭示了MALT1调控的自噬流对PRRSV感染的重要意义。感染早期MALT1维持的自噬流促进病毒释放,帮助病毒早期快速增殖;而病毒复制后期MALT1下调引发的自噬流阻滞和自噬体累积有利于病毒在感染细胞内的贮存,帮助病毒潜伏和持续性感染。

科研与开发科
2024年8月5日