数字 PCR(dPCR)是一种用于定量 DNA 或 RNA 靶标的基于PCR的新兴技术。该方法建立在传统PCR扩增和基于荧光探针的检测方法的基础上,以单分子分辨率实现对核酸分子的精确、绝对定量。
其样本制备步骤与实时(RT)PCR 的步骤相似。将含有靶标序列、引物、探针和其他试剂的反应混合物随机分配到成千上万个通常具有相同体积的分区中,以使每个分区含有靶含 0、1或几个靶标分子。使用荧光探针通过终点法来检测扩增的靶标,以便从所有分区中分别获得单独的荧光亮度值。
图1:分区和扩增后dPCR纳米孔芯片的图像。
在终点检测时,包含扩增的荧光靶标分子的分区被视为阳性分区,而包含很少或没有荧光且没有任何扩增的靶标分子的分区被视为阴性分区。对于每次反应,阳性分区可能含有一个以上靶标分子,阴性分区的比例为使用泊松统计对包含靶扩增序列的分子数量进行定量提供了基础。与定量PCR(qPCR)相比,dPCR可实现更高的精密度、灵敏度和准确度,因为PCR抑制剂的干扰和竞争性背景DNA会因反应混合物的分区而减少。与 qPCR 相比,dPCR 的主要优势包括:dPCR定量更准确,因为它依赖于将分区聚类为阴性和阳性组,然后直接计数阴性分区并计算目标浓度,而无需运行标准曲线。这消除了扩增效率变化影响靶标定量的可能性。相对于潜在PCR抑制剂和干扰背景序列,分区有效富集了靶标阳性分区中的靶标浓度,从而可以更灵敏地检测罕见靶标。
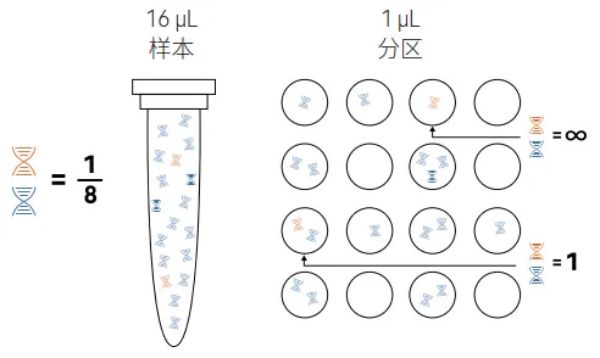
图2:通过分区显示靶序列(橙色)富集相对于竞争性背景序列(蓝色)的图示。在未分区样本中(左侧试管),靶序列与背景序列的比例为 1:8。在靶标阳性分区(右边的圆圈)中,比例从1:1至无穷大(纯靶标)不等。
更高的精密度
分区还可以提高靶标定量的精密度。分区越多,精密度越高。合并多个泳道可以进一步提高精密度。数字PCR仪按照其原理分为油包水液滴式和微孔芯片式,其中微孔芯片式技术较为先进。罗氏公司Digital LightCycler数字PCR仪是最新推出的高性能产品,充分拓展数字PCR的应用领域。
图3.罗氏Digital LightCycler 数字PCR仪
1.应用灵活:纳米微孔芯片技术,3种密度芯片可更换,满足不同应用场景;
2.多重检测:6重荧光多色检测,便于开发更多的应用;
3.高度自动化:分析系统整合PCR反应、芯片检测功能,操作简单;
4.通量高:单次检测8-96个样本,兼顾灵活性与高通量;
5.时间快:单块板1.5h, 12块板4h内完成样品扩增、分析;
6.5倍浓度预混液:可加入更大的样品量,提交检测灵敏度;
大多数dPCR用户仍然使用具有两个光学通道的平台,并依赖于复杂的方法(例如,滴定和混合不同标记的探针)进行多重检测。这些方法需要大量的检测设计专业知识、耗时的优化过程、由经验丰富的用户手动聚类,并且有时会生成难以解读的结果。罗氏Digital LightCycler数字PCR仪的6通道检测系统,通过将每个靶标分配至其自己的光学通道,大大简化了多重检测。多重检测的优点包括:在一次反应中可检测多个目标靶标;可选通道检测额外的质控品或参比品;可减少样本体积要求。下图应用罗氏dRCR仪同时检测禽流感H1、H3、H5、H7、H9亚型和通用型6个病原,各检测通道间无干扰,定量结果准确性高。通道 | 染料 | 目标基因 |
1 | Atto425 | 禽流感H1 |
2 | FAM | 禽流感H3 |
3 | HEX | 禽流感H5 |
4 | Texas Red | 禽流感H7 |
5 | Cy5 | 禽流感H9 |
6 | Cy5.5 | 禽流感通用型 |
表1:6重检测的目标靶标的通道分配。
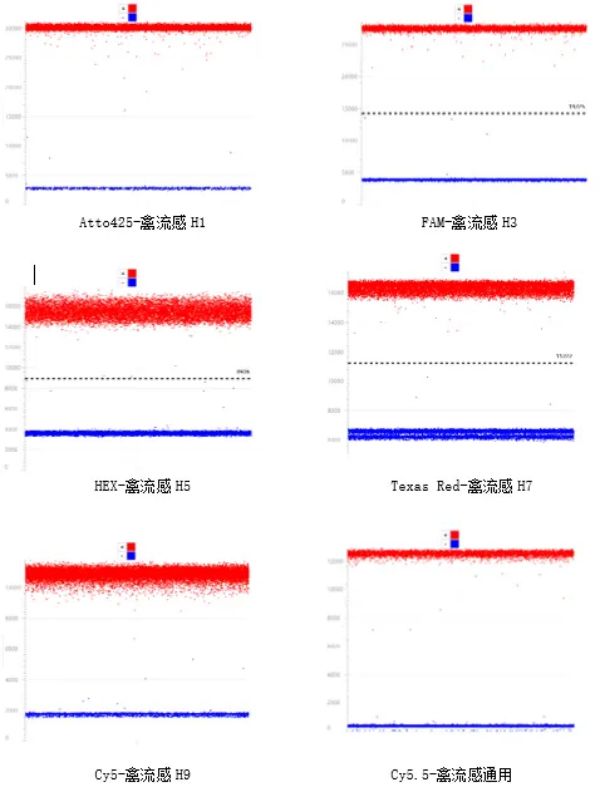
图4.多重病原检测散点图
多重PCR技术一次扩增反应即可实现对多种病原体进行检测,相较单重检测而言成本显著降低。罗氏dRCR采用终点荧光检测和纳米微孔分区技术,检测结果不受扩增效率的影响,能准确定量和避免漏检。
广州市皓博仪器仪表有限公司是瑞士罗氏(ROCHE)品牌的一级代理商。
联系方式:020-34702588 020-34702518网 站:www.gzhopeco.com 或 www.gzhopeco.cn公司地址:广州市番禺区洛浦街上漖村迎宾路99号卓维商务楼201A



