8月16日,美国国家科学院院刊《PNAS》杂志在线发表了中国农业大学动物医学院沈建忠院士和复旦大学附属华山医院胡付品研究员团队题为“Adaptive evolution of carbapenem-resistant hypervirulent Klebsiella pneumoniae in the urinary tract of a single patient”的研究论文。该研究报道了碳青霉烯耐药高毒力肺炎克雷伯菌(Carbapenem-resistant hypervirulent Klebsiella pneumoniae, CR-hvKp)在单例宿主(患者和小鼠)尿路中以黏度表型转变为特征的适应性演化,解析了介导CR-hvKp黏度转变的分子机制,阐明了黏度转变对CR-hvKp感染与定殖的影响,这一发现为理解CR-hvKp在宿主体内的生存策略提供了新线索,同时也为未来对该类细菌的感染控制和治疗策略的开发提供了新思路。

2024年7月31日,世界卫生组织(WHO)紧急发声,警告一类兼具高毒力和多药耐药特征的“超级细菌”——CR-hvKp正全球蔓延,并感叹“其感染程度被严重低估,临床致死病例或超百万”。CR-hvKp能引起动物(牛、犬猫等)和人的致命性感染,且几乎对临床上所有可选抗生素耐药,其致死率接近35%甚至更高。该菌可塑性强,面对各种环境压力能不断发生适应性演化。然而,目前缺乏关于CR-hvKp在宿主体内时间维度上的演化信息,也不清楚其体内演化是否由抗生素压力所驱动。
该文章对单例阴囊脓肿合并尿路感染患者进行追踪,并分析不同病程尿液样本中CR-hvKp分离菌株的生物学特征。结果显示,经过抗生素联合治疗18天后,CR-hvKp的菌落形态出现显著性变异,其中早期菌株(Y8)呈现高黏度表型,后期菌株(Y9)呈现低黏度表型。不同形态菌株的荚膜产量、药物敏感性、生长速率和毒力等生物表型也呈现差异。全基因组对比分析发现,两株菌都属于ST11-KL64血清型,表明单个谱系内的演化而不是谱系间的替换介导了CR-hvKp的表型转换,详见图1。
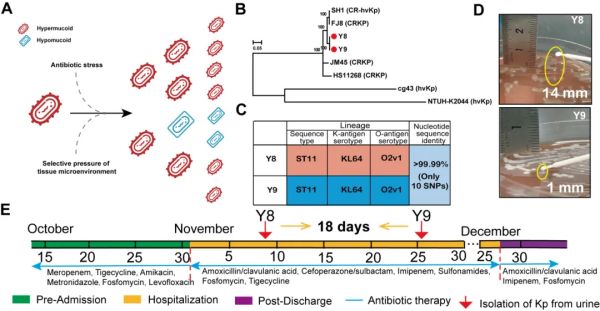
图1. CR-hvKp在单例患者尿路中发生以黏度降低为特征的演化
深入分析两株菌的全基因组序列和RNAseq数据,并开展差异基因功能验证和启动子活性试验等,证实上游插入序列ISKpn26缺失引起的黏度表型调控因子rmpADC表达量下降,是介导CR-hvKp黏度转变的原因,详见图2。
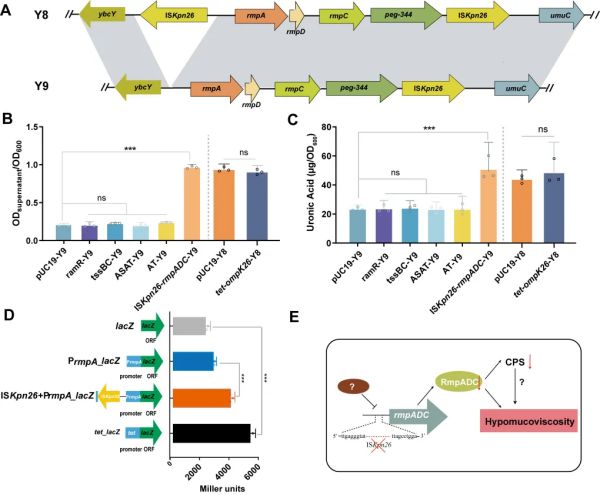
图2. CR-hvKp黏度表型转变的机制
通过小鼠败血症模型、小鼠尿路感染模型、体外细菌-细胞互作和体外细菌-血清/补体互作试验等,评估了黏度转变对CR-hvKp感染与定殖的影响。结果显示黏度转变导致CR-hvKp毒力减弱:败血症模型中小鼠致死率降低了9.0倍,逃避巨噬细胞吞噬能力降低了170.0倍,在小鼠血清中的生长速率下降了11.2-40.9倍,详见图3。
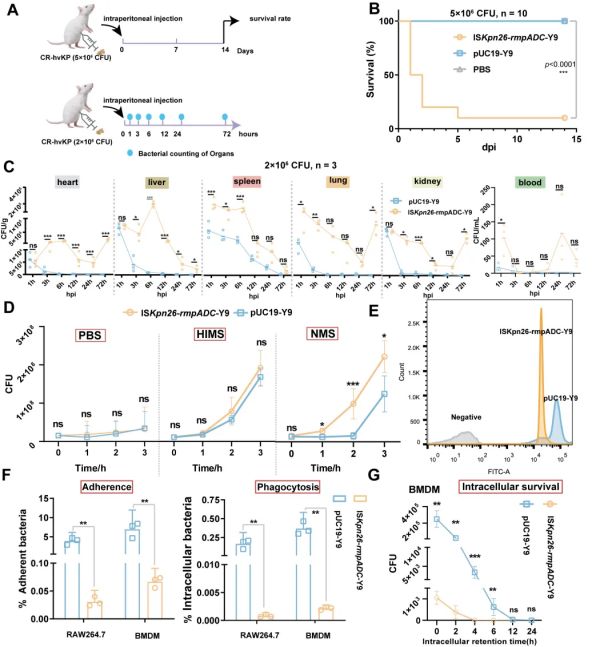
图3. 黏度转变降低CR-hvKp的败血症毒力
然而,黏度转变增强了CR-hvKp的定殖能力:在小鼠尿路中的平均持留时间由6天增加到21天,对膀胱上皮细胞的黏附能力增加了216.4倍,生物膜形成能力增加了48.7%,详见图4。值得注意的是,在小鼠尿路感染模型中成功复现了CR-hvKp的黏度转变,并证明这种演变无需抗生素压力介导。荚膜合成及调控基因wcaJ和rmpA是介导CR-hvKp体内演化的突变热点,而ISKpn26在此过程中发挥关键作用。
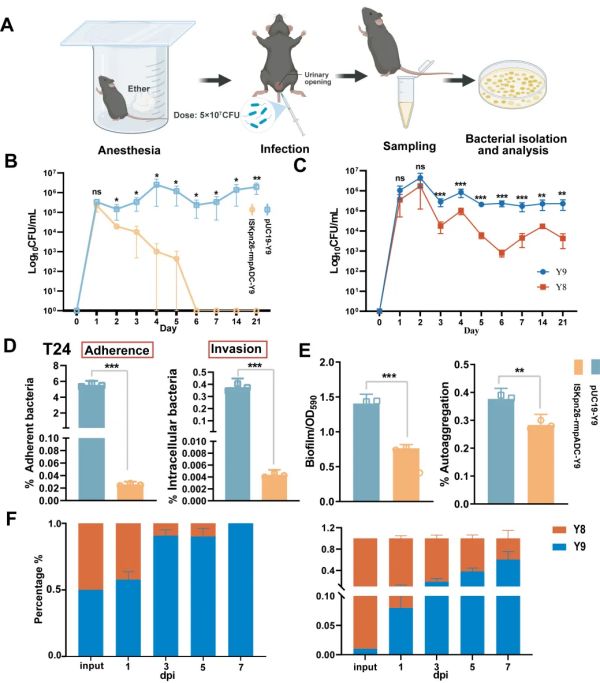
图4. 黏度转变增强CR-hvKp的尿路定殖能力
总之,该研究发现以黏度转变为特征的适应性演化降低了CR-hvKp毒力,但赋予了其尿道生存优势,这种演化不依赖于抗生素压力驱动,是CR-hvKp权衡其感染与定殖能力的结果。
中国农业大学博士毕业生宋士凯(现就职于山东省农业科学院家禽研究所)、硕士毕业生杨诗鑫和在校博士生郑瑞程为论文第一作者,兽医公共卫生安全全国重点实验室沈建忠院士、吴聪明教授、汪洋教授和复旦大学附属华山医院抗生素研究所胡付品研究员为论文共同通讯作者。该研究受国家自然科学基金专项项目“重要耐药菌/耐药基因在“动物-环境-人群”链条中的传播机制和风险研究”(32141002)等资助。