
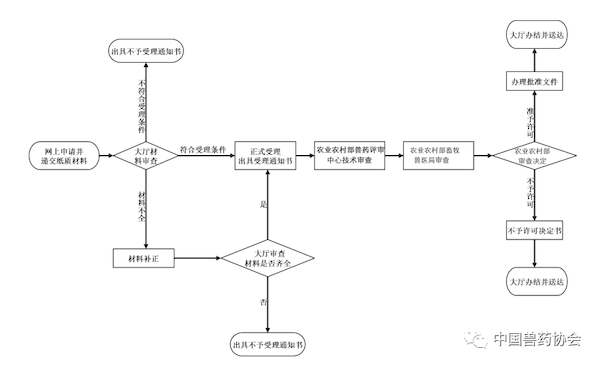
0次。
常见的几种情况如下: (1)两次申报资料相同实验,包括试验时间、地点、操作人员都没有变化,但实验结果或数据不一-致。(2)不同实验报告中使用的不同材料的病理、电镜等试验照片相同或雷同。. (3)不同产品的研发数据相同或雷同。(4)试验时间与制品生产时间不相符或早于实验室试制时间。
应在GMP生产线上,按照产品规程中的工艺,在与该产品商品化生产条件相同的情况下生产5-10批产品。批量可适当减小,但不应为减小批量而改变大生产的条件(如采用与大生产设备或工艺不同的小规模生产设备或工艺)。
根据农业部令第55号规定:临床试验批准后应当在2年内实施完毕。逾期未完成的,可以延期一-年,但应当经原批准机关批准。
根据农业部令第55号规定:临床试验批准后变更申请人的,应当重新申请。
根据农业部令第55号规定:临床试验用兽药仅供临床试验使用,不得销售,不得在未批准区域使用,不得超过批准期限使用。
根据农业部令第55号规定:临床试验应当根据批准的临床试验方案进行。如需变更批准内容的,申请人应向原批准机关报告变更后的试验方案,并说明依据和理由。
来源:农业农村部