来源:华南农业大学兽医学院
近日,兽医学院、国家兽医微生物耐药性风险评估实验室、广东省兽药研制与安全评价重点实验室的孙坚教授在中科院医学一区期刊Drug Resistance Updates(影响因子18.1)和Materials Today Bio(影响因子8.8)上发表了两篇研究长文,分别题为:
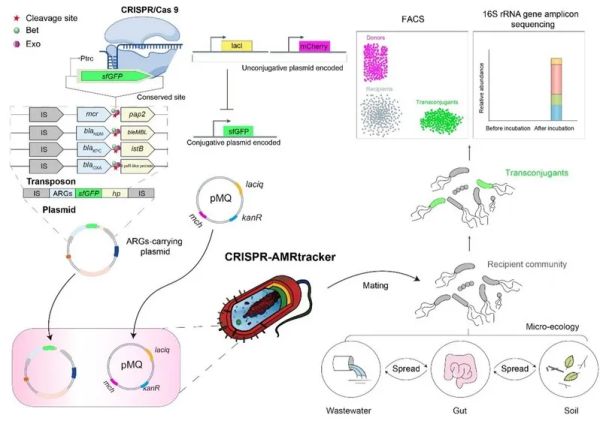
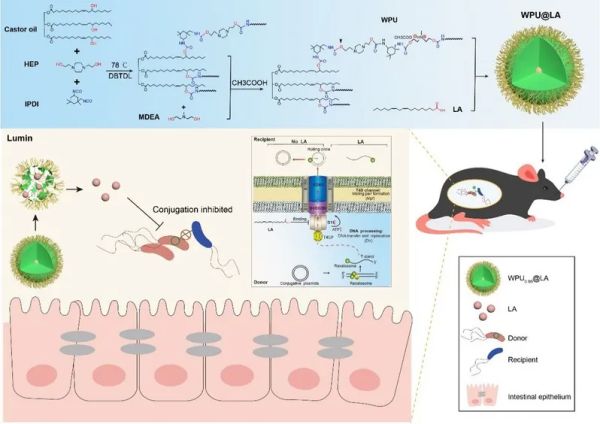
“CRISPR-AMRtracker: a novel toolkit to monitor the antimicrobial resistance gene transfer in fecal microbiota” 和“Waterborne polyurethane nanoparticles incorporating linoleic acid as a potential strategy for controlling antibiotic resistance spread in the mammalian intestine” 。 细菌耐药性导致的死亡人数不断增加,已对全球健康构成严重威胁。耐药基因能够在不同细菌之间水平转移,加速耐药性的传播,而哺乳动物的肠道则是耐药基因转移的主要场所之一。然而,目前研究耐药基因在肠道内的水平转移不仅缺乏有效的监测工具,也缺乏有效的防控策略。 为应对这些挑战,研究团队首先结合CRISPR/Cas9荧光标记、荧光激活的流式细胞分选、16S rRNA基因测序及分析技术,开发了一种名为CRISPR-AMRtracker的创新荧光示踪系统。该系统通过在耐药基因下游的保守区域整合绿色荧光基因,在不影响宿主细胞适应性、接合、转座频率及抗生素敏感性的情况下,有效示踪耐药基因的转移。研究结果表明,荧光标记的质粒可以将可移动的黏菌素耐药基因(mcr-1)从大肠杆菌转移至多种粪便细菌中。此外,团队还研究了一种控制耐药性传播的新策略。在2020年,孙坚教授曾发现亚油酸在体外实验中表现出抑制接合转移的潜力(相关成果发表于Journal of Applied Microbiology)。但由于药物难以有效到达靶位点,其在体内的效果不理想。为此,研究人员使用N-甲基二乙醇胺、2,2'-(哌嗪-1,4-二基)二乙醇、异佛尔酮二异氰酸酯、蓖麻油和乙酸等材料,合成了不同的水性聚氨酯纳米粒子,并包载亚油酸,得到不同的WPU@LA。研究发现,WPU0.99@LA具有良好的pH响应释放特性,且在Caco-2和IPEC-J2细胞模型中的生物相容性较好。此外,每日10 mg/kg剂量的WPU0.99@LA能够将mcr-1质粒在小鼠体内的接合转移频率降低45.1倍,并能有效维持肠道微生物群的稳态,同时表现出理想的生物安全性。这些研究为了解和控制肠道复杂菌群中耐药基因的传播提供了新的视角,并明确了WPU0.99@LA作为哺乳动物肠道内耐药基因传播抑制剂的潜力。 兽医学院博士后李龚与20级博士研究生龙腾飞为Drug Resistance Updates论文共同第一作者,博士后李龚与韩璐为Materials Today Bio 论文共同第一作者,孙坚教授和美国布法罗大学陈亮教授为两篇论文的共同通讯作者。相关研究得到了国家重点研发计划项目、创新研究群体项目、广东省珠江人才计划本土创新科研团队项目、广东省重点研发计划项目、国家重点研发计划项目、广东岭南现代农业实验室项目、双一流学科建设项目、111项目、广东省基础与应用基础研究重大项目以及中国博士后科学基金项目的资助。 相关论文链接: https://www.sciencedirect.com/science/article/abs/pii/S1368764624001006 https://doi.org/10.1016/j.mtbio.2024.101181