来源:扬州大学兽医学院
近日,世卫组织警告高毒力高耐药肺炎克雷伯菌正在全球蔓延,对人类健康造成极大威胁。伴随日益严峻的抗生素滥用问题,抗生素耐药也引发多领域研究者的关注。
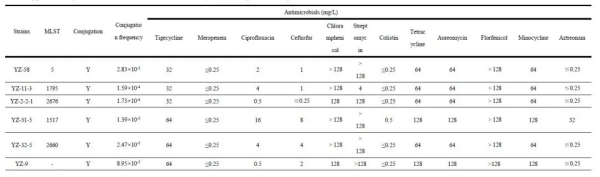
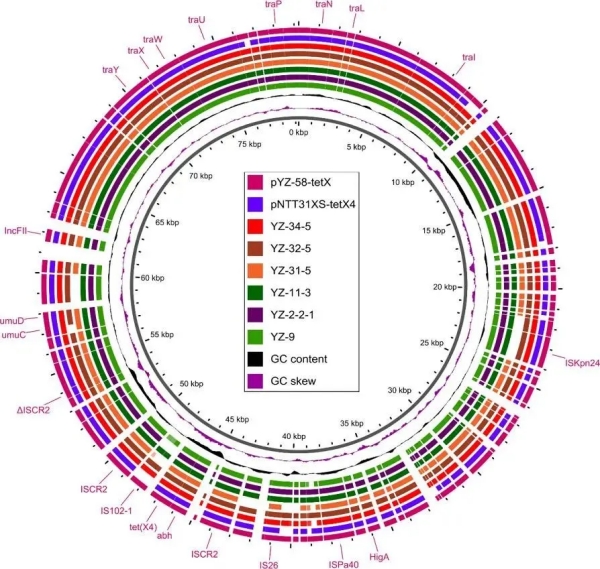
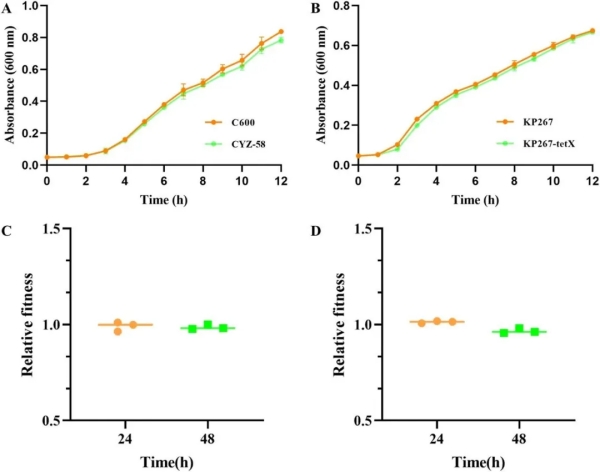
我院王志强教授团队李瑞超教授等基于齐碳科技纳米孔测序平台,对首次在中国动物源性食品样本中分离鉴定出携带tet(X4)基因的高耐药性高毒力肺炎克雷伯菌进行分子特征和基因组学研究。相关研究成果《Emergence of tet(X4)-positive hypervirulent Klebsiella pneumoniae of food origin in China》已于2023年1月发表在期刊LWT上。该研究发现再次突出了全球范围内进行耐药菌监测的紧迫性。

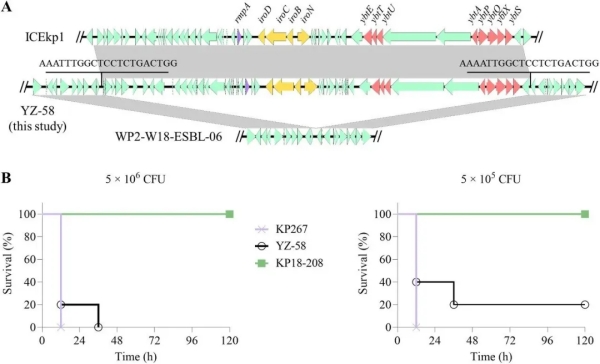
肺炎克雷伯菌(Klebsiella pneumoniae)是一种机会致病性病原体,常趁虚而入导致免疫力低下人群发生感染,由于能够获得外源抗生素耐药基因和毒力因子,使其已成为全球临床和公共卫生机构重点关注的病原之一。其中,碳青霉烯耐药肺炎克雷伯菌 (CRKP) 和高毒力肺炎克雷伯菌(hvKp)是两种临床危害较大的肺炎克雷伯菌亚型。 hvKp 是一种具有高度致病性的肺炎克雷伯菌,已在世界许多地区广泛传播,主要引起社区感染,既往一般不认为其与动物来源的肺炎克雷伯菌有关,导致对动物来源hvKp缺乏了解。MDR-hvKp是近年来进化出的一种新型肺炎克雷伯菌,可携带多种临床重要抗生素的耐药基因,同时表现出高度致病性,在造成严重感染的同时限制了临床用药的选择,因此具有更大威胁。 CR-hvKp同时具有高致病性和碳青霉烯类抗生素耐药性,近年来在临床中也越来越多地发现CR-hvKp导致的败血症和尿路感染等。在中国,CR-hvKp检出率高,其中ST11型CR-hvKp是亚洲最常见的类型之一,被认为是导致中国CRKP流行的主要传播株,对临床治疗构成了最大威胁。 替加环素作为一种临床重要的抗生素,为抵御hvKp和CRKP引起的感染建立了强有力的防线。然而,2019年,中国科学家在人类和动物中发现了质粒编码的替加环素耐药基因tet(X3)和tet(X4),它们能够介导病原体中高水平的替加环素耐药表型。随后,在人类和动物中先后报道了多个可导致替加环素耐药的tet(X)变异体。最近在人体样本、动物来源的食品样本中均发现了tet(X4)阳性肺炎克雷伯菌,这引起了人们的广泛关注,但其传播和流行机制尚不清楚。 李瑞超教授团队从收集的62份猪肉样本中分离出103株四环素耐药菌株,进一步分析得到了6株携带tet(X4)基因的肺炎克雷伯菌,其中一株被鉴定为hvKp。通过齐碳QNome测序平台的全基因组测序、抗菌药物敏感性测试和接合实验,确定了这些分离株的耐药表型、遗传特征和系统发育关系。 本研究首次在猪肉中检出携带tet(X4)的hvKp菌株,并依托齐碳纳米孔测序平台对其进行分子特征和基因组学研究,初步评估该高毒力、高耐药菌株广泛存在造成的潜在风险,突出了全球范围监测的重要性。 总共从62份猪肉样本品中分离出103株四环素耐药菌株,包括95株大肠埃希菌、6株肺炎克雷伯菌和2株枸橼酸杆菌。 抗菌药物敏感性试验结果表明,6株肺炎克雷伯菌对替加环素、土霉素、阿维霉素、氟苯尼考、氯霉素均表现出耐药性,对多粘菌素B和美罗培南敏感。 WGS分析显示,除了tet(X4)基因外,肺炎克雷伯菌分离株中还发现多种药物的重要耐药基因:对β-内酰胺(blaTEM-1, 3/6),酚类 (floR, 6/6),磺胺类(sul2, 5/6)和四环素(tet(A), 6/6),表现出多重耐药性。 为进一步了解tet(X)阳性分离株间的进化关系,团队构建了18株tet(X)阳性肺炎克雷伯菌分离株(6株来自本研究,12株来自NCBI数据库)和5个ST5型tet(X)阴性肺炎克雷伯菌的系统发育树。 毒力基因分析发现,只有分离株YZ-58携带多种重要的毒力基因,它们被认为可作为鉴定hvKp的生物标志物,包括rmpA(调节高黏液型表型的产生)、iuc(产aerobactin)和iro(产salmochelin)。 根据粘性拉丝试验,YZ-58具有高黏液型菌株的表型。 基于齐碳纳米孔测序平台数据表明,YZ-58菌株的tet(X4)基因位于IncFII(pCRY)质粒pYZ-58-tetX上 质粒pYZ-58-tetX大小为79kb,平均GC含量为52.9%。在线BLAST比对分析显示,质粒pYZ-58-tetX与肺炎克雷伯菌中发现的质粒pNTT31XS-tetX4 (CP077430)相似性最高(覆盖度98%,序列一致性100%),与质粒pS234-2(CP102188)骨架结构具有高相似性(覆盖度86%,序列一致性99.99%)。此外,该质粒包含一个由多个tra基因组成的IV型分泌系统基因簇。 除分离株YZ-58外,本研究中其他肺炎克雷伯菌株的tet(X4)基因均位于IncFII(pCRY)质粒上,这些分离株携带tet(X4)的质粒骨架结构与pYZ-58-tetX高度相似(图S2)。这些IncFII(pCRY)质粒可以转移至大肠埃希菌C600和ST11型碳青霉烯类耐药高毒力肺炎克雷伯菌(ST11 CR-hvKp(KP267。连续传代实验结果表明,即使没有外部替加环素压力,tet(X4)和tet(X4)阳性质粒也可以在CYZ-58 (48/48) 和KP267-tetX (48/48)中稳定存在。 在NCBI数据库中通过BLASTn分析表明,IncFII(pCRY)质粒主要存在于肺炎克雷伯菌中。而接合转移结果显示IncFII(pCRY)质粒可以成功地转移到大肠埃希菌和hvKp中,显示出其具有高可转移性。尽管目前tet(X4)阳性大肠埃希菌具有宿主特异性,但其携带的质粒的高度可转移性应引起重视。 随后进一步针对该类型质粒对大肠埃希菌和hvKp的生长影响展开研究,生长曲线显示,接合子的生长速率与C600和KP267没有显著差异(p>0.05) (图4)。这一结果表明,携带tet(X4)基因的IncFII(pCRY)质粒不会显著影响C600和KP267的生长。 本研究从猪肉样本中分离得到6株的tet(X4)阳性肺炎克雷伯氏菌,ST类型各异且tet(X4)基因位于同一质粒IncFII(pCRY)上,并携带多种重要耐药基因,具有多重耐药性。这是首次在全球范围内发现的动物源tet(X4)阳性hvKp菌株。 通过齐碳QNome测序平台进行全基因组测序及质粒特征分析发现,携带tet(X4)基因的hvKp菌株YZ-58与多个国家ST5型肺炎克雷伯氏菌具有高度相似性(基因组差异19~76个SNP),存在克隆传播风险。 IncFII(pCRY)质粒是tet(X4)基因的重要载体,此前大多数IncFII(pCRY)型质粒分布在肺炎克雷伯菌中,在大肠埃希菌中并未发现。本研究接合实验结果显示,tet(X4)遗传元件可转移至大肠埃希菌C600和ST11型CR-hvKp中,表现出高宿主适应性和地理多样性,且具有较高的可转移性。研究还发现,IncFII(pCRY)质粒与ST11型 CR-hvKp的质粒blaKPC-2骨架结构相似,无显著适应代价且能够稳定存在。 令人担忧的是,研究还发现tet(X4)基因可以通过插入序列ISCR2形成一个中间体,使其可能整合到编码blaKPC-2的IncFII(pCRY)型质粒中,导致tet (X4)和blaKPC-2的汇集成为可能,而ST11 型tet(X4)阳性CR-hvKp的出现将严重威胁临床抗感染治疗,使临床治疗面临无有效抗生素可用的困境。 基于本研究成果,强调了针对tet(X4)阳性肺炎克雷伯菌在全球临床和动物养殖环境进一步监测的重要性,应持续关注出现高水平替加环素tet(X4)耐药的高毒力ST11型肺炎克雷伯菌的可能性,并警惕抗生素耐药基因在不同菌属间的转移。