来源:UCVO大会
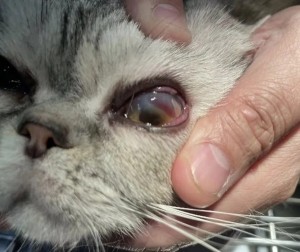
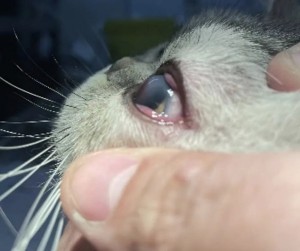
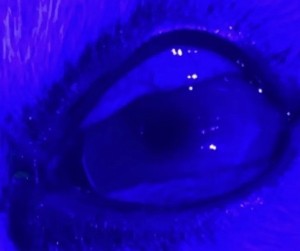
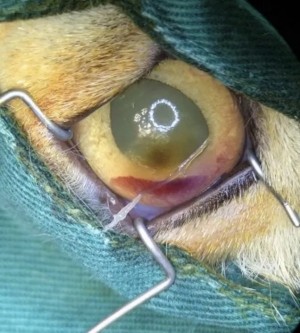
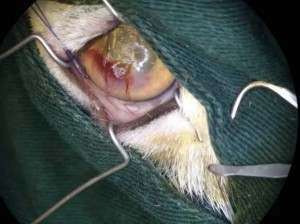
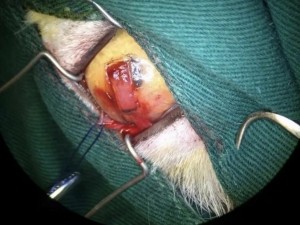
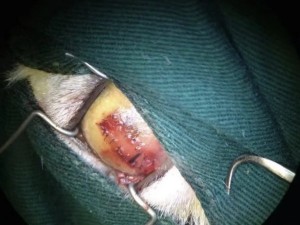
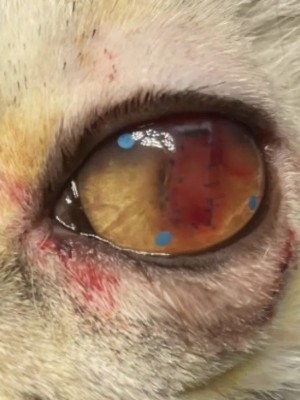
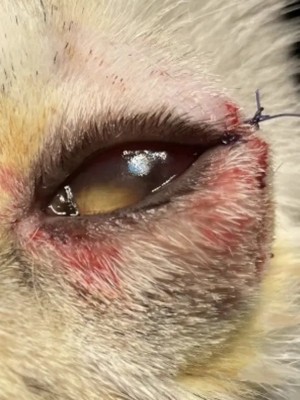
使用角结膜瓣移植术(CCT)在猫坏死性角膜炎的病例报告 Feline Corneal Sequestrum Jason Ong Zinc Jian / 王政权 摘要:一只4岁的混种美国短毛,3.3公斤来到了澳栢兽医诊所就诊,体现了左眼眯眼。体检时,左眼可见单侧眼睑痉挛、溢泪、结膜水肿、眼周瘙痒、角膜水肿、粘液脓性分泌物和角膜显示褐色病变。泪液分泌试验(STT)值为OD8mm/min和OS15mm/min。测量眼内压(IOP)(托诺维特,赫尔辛基,芬兰)OD17mmHg和OS18mmHg。棕色病变周围的左眼荧光素染色呈微弱阳性。角膜拭子细胞学检查呈轻度中性粒细胞斑点。双眼局部使用布比卡因滴眼液(布比卡因0.4%)检查是否存在异物及双睫。口服药物和滴眼剂,如左旋滴眼液+血清(4:1)TID-QID、透明质酸(SODAGO)BID、lubrithal眼凝胶BID、泛昔洛韦90mg/kgBID、强力霉素5mg/kgBID和美康PO SID1.5个月但没有任何改善。选择进行板层角膜移植术、CCT和临时眼睑角膜移植术来去除缺损角膜。2周后患者出院,1个月后恢复良好,角膜透明度II级。1年后,患者再次复查,角膜清晰度为0级。此后,患猫生活质量良好。 一 病史 该患猫分别出现单侧眼睑痉挛、溢泪、结膜水肿、眼周瘙痒、角膜水肿、粘液脓性眼分泌物和左眼棕色角膜病变(图1)。饲主诉说患猫有眯眼、过度抓伤眼部、流泪过多、左眼眼睑发红和发炎的情况持续了数周。双侧眼睛存在威胁反应、棉球试验、迷宫试验、瞳孔对光反射(PLR)、眩光反射、眼睑反射、角膜反射等眼科检查。检查时左侧的眼角膜敏感。泪液分泌试验 (STT) 值为OD8mm/min和OS15mm/min。测量眼内压 (IOP)(Tonovet,Helsinki,Finland)OD17mmHg 和OS18mmHg。棕色病变周围的左眼荧光素染色呈微弱阳性(图2)。角膜拭子细胞学检查呈轻度中性粒细胞斑点。双眼局部使用布比卡因滴眼液(布比卡因0.4%)检查是否存在异物及双睫。由于财务限制,未进行细菌培养和猫呼吸道病毒的聚合酶链反应(PCR)。 图1(a) 一只4岁混种美短受影响左侧眼睛的正面图像 图1(b) 一只4岁混种美短受影响左侧眼睛的侧面图像 图2(a) 荧光素钠测试图像 图2(b) 荧光素钠测试图像 二 诊断与怀疑方向 临床鉴别诊断为角膜溃疡、角膜炎和猫坏死性角膜炎。然而,该患猫由于其特殊特征,如角膜中央存在圆形浅茶色病变和角膜基质凝固性坏死区域,被诊断为猫角膜死骨[2]。这些死骨区域可能涉及所有角膜层并可能导致穿孔[1]。尽管荧光素钠可能不会被坏死的基质保留,并且它们可以延伸到不同的基质深度,但上面的上皮经常溃疡。角膜周围可能有不同程度的血管化,病变周围可能有炎症浸润[6]。 确切的发病机制尚未得到证实,角膜死骨很可能是对慢性角膜刺激的非特异性反应。诱发因素包括短头畸形、睫毛倒插或眼睑内翻造成的角膜创伤、或泪膜定量或定性异常、兔眼症和眼睑功能异常导致的角膜干燥。大多数猫坏死性角膜炎经常发生在短头品种猫身上,例如波斯猫[1,9,11]。在一些猫坏死性角膜炎发现了诸如猫疱疹病毒1(FHV-1)和弓形虫 DNA 等传染源[12]。一项研究表明,55.1% 患有坏死性角膜炎的猫被诊断为FHV-1阳性[9]。在一项回顾性研究中,波斯猫品种是角膜死骨影响最大的品种(71.5%),其次是异国短毛猫(12.2%)、家养短毛猫(12.2%)和其他品种(4.1%)[8]。 CCT已被证明是治疗猫坏死性角膜炎有效的手术方案,具有良好的长期术后效果 [1,3]。CCT维持受影响区域的持续血液供应,并且不需要供体材料。它们提供了角膜基质组织的直接来源来填充缺损,并且该技术可用于全层病变。与结膜蒂移植物(CPG)相比,CCT的优点包括卓越的轴向透明度,因此可以更好地保留视力。据报道,准备CPG的并发症包括死骨复发、角膜脓肿和持续存在角膜血管至结膜疤痕。 Featherstone et al.报道,单独使用角膜切除术(25%)或联合CPG或SIS移植物(17%)治疗死骨的复发率没有显着差异,复发定义为需要进行第二次手术。Graham等人报告称,采用角膜切除术和CCT治疗时,总体复发率为8.3%。Andrew et al.2001报道称,17个死骨接受了角膜切除术和CCT治疗,在30天到7年的随访期间没有显示任何复发迹象。 三 治疗 口服药物和滴眼剂,如左旋滴眼液+血清(4:1)TID-QID、透明质酸(SODAGO)BID、lubrithal眼凝胶BID、泛昔洛韦90mg/kgBID、多西环素5mg/kgBID和美康PO SID持续1.5个月(表1)。治疗无法缓解症状,因此主人选择了手术作处理。 表1 患猫使用的药物和滴眼剂 药物和点眼 名称 lubrithal眼凝胶 泛昔洛韦 多西环素 透明质酸点眼 可樂必妥眼藥水 准备手术器械和耗材,如BioSIS ECM眼盘、Colibri镊子、缝合线PGA10-0、高尔夫刀、基本眼科器械、眼睑牵开器和Meni-one角膜绷带(表2)。 表2 手术所用的仪器和材料 器械和耗材 名称 Meni-One角膜绷带 基本眼科器械 BioSIS ECM 眼盘 缝合线 PGA 10-0 眼睑牵开器 手术使用了美托咪定(2-10ug/kg)和布托啡诺(0.1-0.3mg/kg)。对患猫进行插管并使用异氟烷和氧气供应进行维持。术前使用托吡卡胺滴眼液以达到散瞳的目的。使用托吡卡胺滴眼液的目的是改善逆照照明,从而更容易观察坏死角膜区域的完全切除。 患猫取仰卧位,用5%聚维酮碘溶液和无菌0.9%氯化钠溶液准备眼周皮肤、眼表和结膜囊。放置内侧和外侧留缝线(尼龙6-0)和线眼窥镜以稳定眼球(图3)。 图3(a) 手术准备 图3(a) 手术准备及使用眼科显微镜 根据基质坏死的深度进行浅层或深层角膜切除术。使用高尔夫球刀在缺损区域周围制作方形手术形状。死骨估计占角膜基质深度的50%。接下来,制备背侧滑动角结膜移植物,其具有从病变处延伸至角膜缘并进入球结膜的发散的半厚度切口。用高尔夫球刀和角膜解剖器破坏移植物的角膜部分。其宽度比角膜切除部位宽约3毫米。一旦移植物完全准备好,转位能够覆盖缺损,然后慢慢地逐层去除角膜缺损,直到角膜达到所需的透明度。 图4(a) 板层角膜切除术 图4(b) CCT向缺损区域的背侧滑动 接下来,将移植物推进到缺损处,使其前缘相对,并用10-0PGA以简单的间断缝合到位。然而,两个移植物的侧边缘也用10-0PGA以简单的间断缝合到位(图5)。 图5(a) CCT缝合过程 图5(b) CCT缝合过程结束 在左眼使用Meni-One保护绷带。当基质层角膜切除率低于50%时,建议应用保护性绷带或临时睑板缝合术如第三眼睑膜瓣术(NMF)来覆盖手术区域[7]。角膜切除术涉及超过50% 的基质层,建议使用构造支撑。在感染情况下,不建议使用NMF技术,因为它会促进细菌生长,并阻止滴眼液到达治疗区域。在这种情况下,在应用保护性角膜绷带后,进行了半眼睑睑板缝合术(图6)。 角膜移植术(CCT)是手术治疗的最佳选择,因为它可以在术后3至4周内实现清晰的视力轴[10]。并提供物理支持[5]。据报道死锁复发率较低 (5%);然而,排斥反应仍然是与角膜移植相关的主要并发症之一[5]。 图6(a) Meni-One保护性角膜绷带的应用 图6(b) 临时眼睑缝合术 使用双层伊丽莎白项圈以避免刮伤手术部位。患猫住院10天后出院。 四 跟进 出院两周后,患猫被带到诊所拆除眼睑缝合术的缝合线。术后3周后拆除角膜保护绷带。 术后1个月患者再次复诊检查手术区域。角膜混浊程度轻微,约为II级(图7(a)),绒毡层反射和PLR等检查均为阳性。使用检眼镜检查眼底,由于角膜清晰度较差,所以有些不清楚(图7(b))。 图7(a) 受影响区域的角膜透明度分类 手术一年后,患猫再次复查。角膜混浊评价不存在,角膜透明度为0级。采用检眼镜评价眼底,能清晰观察眼底的细节特征。 图7(b) 术后1个月左眼的外观 图8 1年后左眼的物理外观 五 总结 总之,CCT是猫坏死性角膜炎的最佳手术选择,其中保留角膜透明度和视力是治疗结果的目标。 参考文献 [1]Andrew, S.E.,Tou, S.&Brooks, D.E.(2001) Corneoconjunctival transposition for the treatment of feline corneal sequestra: a retrospective study of 17 cases (1990-1998). Veterinary Ophthalmology 4,107-111 [2]Cullen CL, Wadowska DW, Singh A, Melekhovets Y. Ultrastructural findings in feline corneal sequestra. Vet Ophthalmol 2005;8:295–303 [3]Graham KL, White JD, Billson FM. Feline corneal sequestra: outcome of corneoconjunctival transposition in 97 cats (109 eyes). J Feline Med Surg. 2017;19:710-716. [4]Featherstone HJ, Sansom J. Feline corneal sequestra: a review of 64 cases (80 eyes) from 1993 to 2000. Vet Ophthalmol. 2004;7:213-227 [5]Laguna F, Leiva M, Costa D, Lacerda R, Peña Gimenez T. 2015. Corneal grafting for the treatment of feline corneal sequestrum: A retrospective study of 18 eyes (13 cats). Vet Ophthalmol 2014;18:291–296 [6]Lyne SS, Bianca SB, Bruce HG. 2015. Diagnostic Opthalmology vol 56, 1197-1198. [7]Maggs, D., Miller, P. & Ofri, R. (2017) Slatter’s Fundamentals of Veterinary Ophthalmology. 6th edn. Philadelphia, PA: Saunders Ed [8]Multari D, Perazzi A, Contiero B, Carobbi B, Bertoldi M, Iacopetti I. 2021. Corneal sequestra in cats: 175 eyes from 172 cases (2000-2016) Journal of Small Animal Practice. BSAVA. [9]Nasisse MP, Glover TL, Moore CP, Wigler BJ. Detection of feline herpesvirus 1 DNA in corneas of cats with eosinophilic keratitis or corneal sequestration. Am J Vet Ophthalmol 1998;59:856–858. [10]Peña Gimenez, M. T. & Fariña, I. M. (1998) Lamellar keratoplasty for the treatment of feline corneal sequestrum. Veterinary Ophthalmology 1, 163-161 [11]Pentlarge VW. Corneal sequestration in cats. Compend Contin Educ Pract Vet 1989;11:24–32. [12]Stiles J, DcDermott M, Bisgsby D, et al. Use of nested polymerase chain reaction to identify feline herpesvirus in ocular tissue from clinically normal cats and cats with corneal sequestra or conjunctivitis. Am J Vet Res 1997;