圣湘生物(688289)2020年年报笔记
近期事宜
2021年6月
圣湘生物科技股份有限公司(以下简称“圣湘生物”、“公司”、“投资方”)与深圳市真迈生物科技有限公司(以下简称“真迈生物”)及其股东深圳市中科达瑞基因科技有限公司(以下简称“中科达瑞”)、深圳闪士多实业有限公司(以下简称“深圳闪士多”)、深圳市万力拓电子商务科技有限公司(以下简称“深圳万力拓”)签订《投资协议》,公司通过股权转让、认缴新增注册资本的方式,以合计 25,520 万元人民币的价格取得真迈生物 14.767273%的股权(以下简称“本次交易”),相较真迈生物 2020 年经审计的净资产 76,275,581.45 元人民币,其溢价率约为 22 倍。公司将以自有资金完成前述交易。
2021年2月
公司拟出资 450.00 万元与公司关联法人珠海维宇同益管理咨询企业(有限合伙)(拟定名,具体以工商核名为准,以下简称“珠海维宇同益”)共同设立合资公司大圣宠医(湖南)生物科技有限公司(拟定名,具体以工商核名为准, 以下简称“大圣宠医”或“合资公司”),该合资公司主要以公司主营业务分子诊断、基因检测技术为核心,集诊断试剂、仪器和第三方检验服务为一体,推广其在宠物(含经济宠物)检测领域的延伸应用。合资公司注册资本3,000.00 万元, 其中本公司以自有资金出资人民币 450.00 万元,占比 15.00%。
拟经营范围:动物防疫诊断技术、保健技术的研究、开发和产品销售;生物试剂、疫苗、环保设备、保健品、通用仪器仪表、医药辅料、兽用器械的销售;兽药经营:兽用生物制品销售;货物或技术进出口、产品代理进出口(国家限定公司经营或禁止进出口的商品和技术除外)(以工商注册为准)。
摘要
报告期内,公司营业收入同比增长1,203.53%,归属于上市公司股东的净利润同比增长6,527.90%,归属于上市公司股东的扣除非经常性损益的净利润同比增长 6,786.15%,主要系报告期内,面对全球突发疫情,公司积极响应,根据不同抗疫时期、 不同应用场景需求、不同国情构建起了全场景化新冠检测整体解决方案,全力以赴服务疫情防控。公司所开发的产品较好地满足了市场需求,新冠核酸检测试剂、核酸检 测仪器、相关耗材、检验服务等产品及服务的销售业绩取得重大突破,同时,公司仪器销售及装机增长进一步带动公司全线试剂的增量销售,2020年公司全年仪器累计发货6,122台,由此可以持续发挥新冠抗疫优势,加速提升全线产品市场占有率。通过新冠抗疫,公司国际化步伐大幅提速,产品服务区域从2019年的40多个国家快速发展到近160个国家和地区,境外营业收入占比由2019年的4.98%提升到 53.49%,公司品牌知名度和美誉度显著提升,渠道建设也得到极大加强,全球七大区域中心布局加速推进。“圣湘方案”进入众多国家政府采购目录,并与当地大使馆、卫生部和红十字会等机构建立了深入和长期联系,这也将大幅加速公司全线产品进入各国疾病防控体系。综合前述情况,公司2020年度整体销售情况及经营业绩较上一年度有了较大幅度的提升。
公司简介
公司全称:圣湘生物科技股份有限公司
法人:戴立忠
董秘:彭铸
公司办公地址:长沙高新技术产业开发区麓松路680号
会计师事务所:中审众环会计师事务所(特殊普通合伙)
签字会计师姓名:李新首、邹华娟
保荐机构:西部证券股份有限公司
保荐代表人姓名:李锋、邹扬
业务
主要业务
公司是一家以自主创新基因技术为核心,集诊断试剂和仪器的研发、生产、销售,以及第三方医学检验服务于一体的体外诊断整体解决方案提供商。
公司系国内技术先进、产品齐全的体外诊断领军企业之一,致力于成为全球领先的创新型高端分子诊断企业和基因科技的普惠者,服务于各类疾病防控、突发疫情防控等全民健康事业,助力国家精准医疗体系和分级诊疗体系建设。
公司自主开发了病毒性肝炎、生殖感染与遗传、儿科感染、呼吸道感染、核酸血液筛查、自动化仪器等优势产线,并进一步向肿瘤早筛、肿瘤个体化用药、慢病管理、公共卫生、动物疫病防控、科研服务等领域拓展,开发了性能优良的产品400余种,可提供各类优质检测服务2,200余项。公司建立了完善的全流程质控体系和营销服务体系,产品已远销全球近160个国家和地区。
公司已取得国内外300余项注册证书,包括一类产品备案证书6项,二类注册证书70 项、三类产品注册证书29 项、药品注册证书1项,100个产品获得欧盟CE认证,同时多个产品获得巴西、美国等国家食品药品管理局注册认证。
主要经营模式
公司以体外诊断相关的“仪器+试剂+服务”一体化为经营模式,主营业务为体外诊断试剂、配套检测仪器等体外诊断产品的研发、生产和销售和第三方医学检验服务,拥有完整的研发、采购、生产、销售及服务体系。
公司通过自我研发,向合格供应商采购所需的原材料,通过组织生产形成体外诊断试剂及仪器,以“直销和经销相结合”的销售模式,最终销往医院、第三方检测机构、体检机构、疾控中心、科研单位等用户。
所处行业情况
公司所处行业发展阶段
根据《上市公司行业分类指引》,公司属医药制造业(分类代码C27),血筛类产品属于医药制造业中的生物药品制造(C2761);根据《国民经济行业分类》,属医药制造业中的医疗仪器设备及器械制造行业(分类代码C358)。公司目前主要产品属 于《体外诊断试剂注册管理办法》规定的体外诊断试剂。
随着人们对健康需求的日益增加,对于疾病的风险预测、健康管理、慢病管理等领域都有更高的要求,体外诊断也受到越来越多的关注。据中商产业研究院数据统计, 2017年全球体外诊断市场规模达到了645亿美元,预计2018年到2025年复合均增长率达到4.8%,2019 年全球体外诊断市场规模约 700 亿美元,预计到 2025 年市场规 模将达到 936 亿美元。随着我国医疗消费水平不断升级,医疗体制改革的推动以及“健康中国2030”战略的推进,体外诊断行业已驶入持续高速发展的快车道。2020 年受新冠疫情的影响,体外诊断尤其是分子诊断市场需求猛增,我国体外诊断行业迎来井喷式发展。
汇总国内外有关中国体外诊断市场信息,去除非工业口径的数据,2018 年中国体 外诊断市场规模超过 800 亿人民币,同比增长15%左右。2019 年中国体外诊断市场规模突破 900 亿人民币,经过 2020 年疫情的洗礼之后,市场已达到千亿规模,中国已经成为全球 IVD 增速最快的市场之一。从细分领域看,分子诊断在2020年之前的市 场增长速度超过25%,是IVD赛道发展最快的领域,2020在精准医疗需求的推动以及 新冠肺炎抗疫时期特殊影响下,分子诊断市场增长进一步提速。
据中国医保商会统计资料,我国医疗器械进出口贸易保持11年持续增长势头。2019 年我国医疗器械进出口总额为 554.87 亿美元,较上年增长 21.16%。2020 年全球 新冠肺炎抗疫工作中,中国体外诊断产品方案获得全球认可,在全球抗疫工作中做出 巨大贡献。尤其是新冠病毒核酸检测产品,累计出口数亿人份。总体上看,我国医疗 器械对外贸易结构继续优化,体外诊断产品所占比重有所增加,质量效益持续提升, 较好地适应了国际市场的需求和复杂变化。随着相关企业的不断开拓进取,我国体外 诊断产业创新质量将不断提升,涌现出一批具备国际竞争力的优秀企业,IVD 出口贸 易将进入高速发展期。
2020 年抗击新冠肺炎疫情极大推进我国核酸检测基础能力建设,国务院联防联控 机制最新数据显示,截至 2021 年 1 月 13 日,全国已有 8437 个医疗卫生机构可以开 展核酸检测,是2020年3月底可以开展核酸检测医疗卫生机构的4倍,已全面广泛覆盖县级医疗卫生机构。如此庞大的核酸检测能力是我国社会和医疗卫生体系的宝贵财富,除了应对新冠等突发疫情,还可在我国传染病防控(如呼吸道感染疾病、艾滋病、病毒性肝炎、结核病、手足口病等)、肿瘤防控、慢病管理中发挥重要作用。随着精准医疗发展趋势和全场景化普适化的分子诊断技术手段的不断创新升级,未来相当长一段时间内分子诊断领域仍将保持快速增长。
分子诊断市场发展将继续领跑体外诊断行业
分子诊断正处于高速发展阶段,增长速度惊人,作为生命科学最前沿的技术,承载着未来精准医学发展的核心,现已广泛应用于传染病、肿瘤、遗传病、产前筛查等领域。据行业报告(浙商证券)数据显示,2013-2019 年全球分子诊断市场规模CAGR 为12.18%,远超IVD行业整体的4.99%;而我国分子诊断市场年复合增长率达到 31.63%, 预计在不考虑新冠疫情因素的情况下有望在较长时期维持20%-30%左右的行业增速,领跑体外诊断行业,我国分子诊断市场虽然仅占全球市场规模的 16.86%,但是增速约为全球增速的 2.6 倍。
2020 年抗击新冠肺炎疫情极大推进我国核酸检测基础能力建设,国务院联防联控机制最新数据显示,截至2021年1月13日,全国已有 8437 个医疗卫生机构可以开展核酸检测,是2020 年3月底可以开展核酸检测医疗卫生机构的4 倍,已全面广泛覆盖县级医疗卫生机构。如此庞大的核酸检测能力是我国社会和医疗卫生体系的宝贵财富,除了应对新冠等突发疫情,还可在我国传染病防控(如呼吸道感染疾病、艾滋病、病毒性肝炎、结核病、手足口病等)、肿瘤防控、慢病管理中发挥重要作用。随着精准医疗发展趋势和全场景化普适化的分子诊断技术手段的不断创新升级,未来相当长一段时间内分子诊断领域仍将保持快速增长。
公司所处的行业地位分析及其变化情况
病毒性肝炎系列产品方面,公司承担了国家“十二五”、“十三五”重大科技专项和国家“863”计划等国家级重大项目,基于超顺纳米磁珠法核酸提取技术和一步法快速核酸释放技术,公司开发了一系列病毒性肝炎核酸检测系列产品,覆盖了病毒性肝炎诊断、治疗方案确定、治疗随访监测、耐药监测、治疗终点判断等病毒性肝炎诊疗全过程,已在全国绝大多数标杆医院和第三方实验室广泛使用。公司于2019年注册的超灵敏乙肝和丙肝核酸检测试剂,灵敏度分别为5IU/mL 和12IU/mL,达到国际领先水平,2020年全国室间质量评价活动中乙肝、丙肝核酸检测试剂实验室用户数保持第一,持续保持在病毒性肝炎核酸检测市场的领先优势。世界卫生组织(WHO)提出了到 2030年消除病毒性肝炎公共危害的目标,随着我国以及全球病毒性肝炎防控工作不断深化,肝炎病毒核酸定量检测已成为防控工作中的重要一环,公司不断开发完善的肝炎防控系列产品也必将会有更加突出的市场表现。
新冠病毒检测及呼吸道产品方面,公司基于 10 余年技术沉淀和丰富的产业化经验、产品应用经验,72小时开发出新冠病毒核酸检测试剂,后续又推出了“分钟级”快速核酸检测设备、新冠抗原检测试剂、新冠/甲流/乙流三联检核酸检测试剂(抗原检测)、新冠变异病毒鉴别诊断试剂等一系列抗疫产品,并根据不同抗疫时期、 不同应用场景需求、不同国情构建了全场景化新冠检测整体解决方案,助力全球疫情防控,已服务全球近160个国家和地区,成为国内新冠病毒核酸检测试剂出口量较大的企业之一,帮助国内外数千家实验室核酸检测能力从无到有或数倍到数十倍增长。新冠“圣湘方案”在法国、阿联酋、菲律宾、塞尔维亚等全球众多国家成为当地抗疫核酸检测主导方案,部分国家市场占有率超过 80%,让世界各国进一步了解和认可“中国抗疫经验”、中国“抗疫方案”。呼吸道病毒病原体六联检、呼吸道病原菌七联检、 新冠及甲乙流病毒联检产品已获得CE注册,预计将在2021年获得国内注册上市,能够对呼吸道感染性疾病进行精准鉴别诊断,为我国呼吸道感染性疾病防控提供精准指导。
核酸检测仪器设备产品方面,公司开发了 iPonatic、Natch 48、Natch 96、 Natch S、Natch CS、Natch CS2、Fast DP01、Fast DP02 等一系列自动化核酸提取系 统,改变了原来PCR 实验室手工操作为主的应用现状,实现了实验室从原始样本前处 理到常温裂解、核酸提取、PCR 反应体系构建等全流程的一站式自动操作,集成打造 高通量、高精度、高效率的现代分子实验室系统解决方案。
2020 年公司仪器总发货量达到6,122台,是公司成立以来到2019 年的发货量总和的近6倍。公司销售的检测仪器和自产试剂具有较好的匹配性,因此装机仪器不仅适用于新冠病毒核酸检测,也可适用于其他众多主流核酸项目检测,仪器销售及装机增长将进一步带动公司全线试剂的增量销售,加速提升全线产品市场占有率。另外,公司还创新开发注册了POCT移动核酸检测系统,能够实现“分钟级”核酸检测,突破传统 PCR实验室限制,实现应用场景突破,为发热门诊、急诊及基层医疗机构、健康管理、军事安全、生物应急等领域提供现场即时快速核酸检测解决方案。
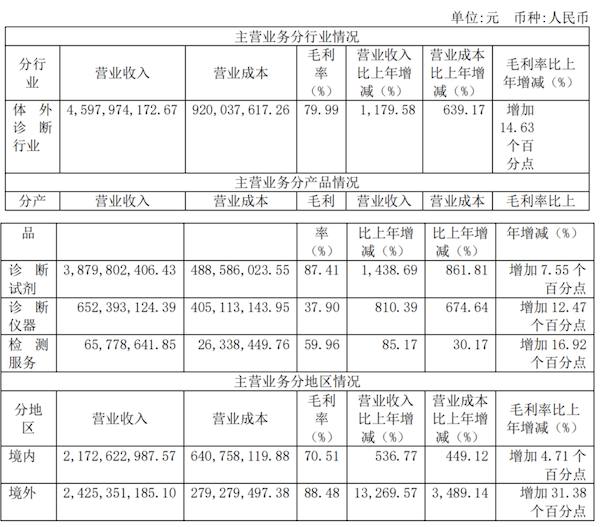
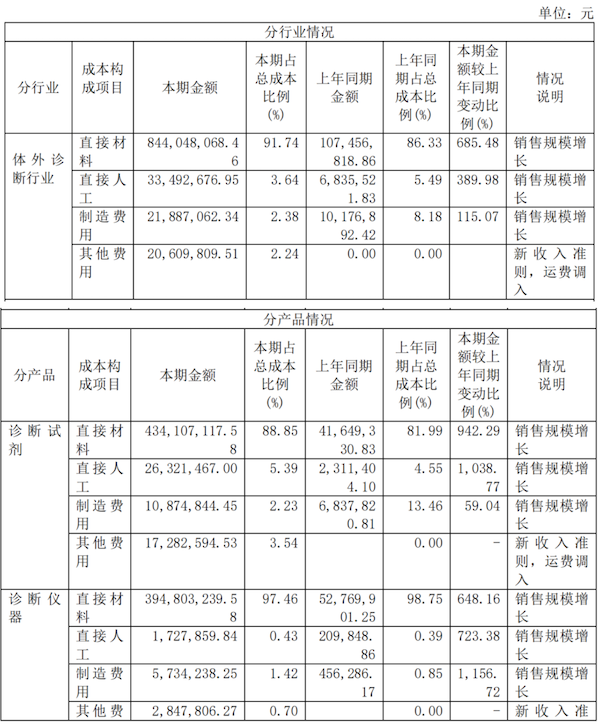
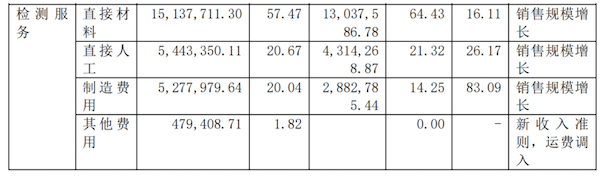
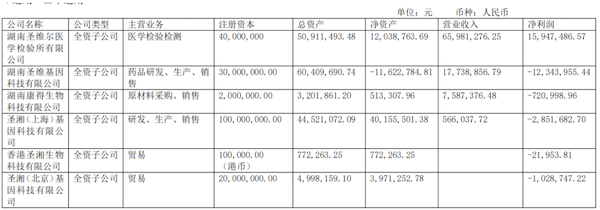
主营业务分行业、分产品、分地区情况

刘让蛟
1991 年 7 月至 1994 年 9 月,于北京大学担任助教、讲师;1994 年 9 月至 1999 年 6 月,于美国俄勒冈大学担任助教、助研;1999年7月至2000年9月,于美国牛津分子集团公司担任软件工程科学家、资深工程科学家;2000年9月至2009年11月,于美国辉瑞公司担任研究应用设计师、研发经理;2009年11月至2013年2月,于美国康宁公司担任高级研究经理;2013年4月至2016 年12月, 于美国杰克逊实验室担任高级科学软件工程师;2017 年 1 月至 2018 年 2 月,于天津诺禾致源生物信息科技有限公司担任副总经理。2018 年 3 月至今,历任公司生命科学研究院副院长、首席信息官。
陈兵
2011年10月至2014年1月,于华润医药集团有限公司任助理经理;2014年2月至 2014年9月,于英飞尼迪股权基金管理集团任投资副总监;2014年10月至2017年5 月,于江苏弘晖股权管理有限公司历任副总裁、执行董事,2017年6月至今,任江苏弘晖股权投资管理有限公司合伙人、创新行业主管。2018年1月至今,任公司监事。
员工数量
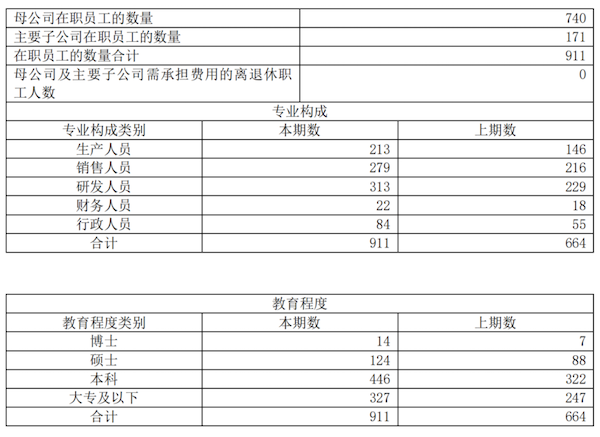
摘自:圣湘生物2020年年报