各省、自治区、直辖市畜牧兽医(农牧、农业)厅(局、委、办),新疆生产建设兵团畜牧兽医局:
为保证新修订《兽药产品批准文号管理办法》(农业部令2015年第4号)顺利实施,我部组织制定了《兽药比对试验要求》和《兽药比对试验目录(第一批)》,现予发布,请遵照执行。
农业部办公厅
2016年5月5日
附件一
兽药比对试验要求
按照《兽药产品批准文号管理办法》规定,申请兽药产品批准文号需要实施的比对试验包括生物等效性试验和休药期验证试验。生物等效性试验应按照农业部发布的《兽用化学药品生物等效性试验指导原则》进行;休药期验证试验应按照农业部颁布的《兽药残留试验技术规范(试行)》进行。
一、基本原则
按照科学合理、分类实施、逐步推进的思路,依据产品注册情况以及兽药剂型性质与特点,分期、分类实施比对,具体品种以农业部发布的比对试验目录为准。首先对进口兽药和2016年5月1日起监测期满的新兽药实施比对试验,之后再分步对其他兽药实施比对试验。
原则上,受试品应与参比品最高含量规格实施比对,其他低含量规格不再实施比对。若受试品有多个规格,而参比品只有一个规格的,则只与参比品批准的规格实施比对。
二、参比品、受试品的选择与要求
参比品 原则上应为原研发生产企业的产品。若原研发生产企业的产品不再销售,则应选择市售合格的该品种主导产品,并由农业部公布。参比品由比对试验实施机构负责购买,经中国兽医药品监察所检验合格后方可进行比对试验。
受试品 应为符合兽药国家标准的产品,并在兽药GMP生产线上抽取,经省级兽药检验机构检验合格后方可用于比对试验。
三、试验动物的种类要求
原则上应为参比品批准使用的靶动物。其中批准使用的靶动物为多种动物的,畜禽应分别开展试验,家畜优先选择猪,家禽优先选择鸡,宠物优先选择狗。只有牛羊的,优先选择羊。
四、血药浓度法生物等效性试验要求
能够用血药浓度法进行生物等效性试验的制剂品种,应优先进行血药浓度法生物等效性试验。
进行生物等效性试验除应遵循农业部发布的《兽用化学药品生物等效性试验指导原则》之外,还应注意以下几点:
(一)试验设计
用家畜作为试验动物的,一般选择交叉设计。若药物有很长的消除半衰期或者交叉设计时两阶段间的清洗期持续时间太长,以至试验动物出现明显的生理变化时,可选用平行设计。
用鸡作为试验动物的,一般选择平行设计。
选择平行设计的,试验动物数量每组不少于30头(只)。
(二)给药剂量
一般只做单剂量试验。给药剂量应与临床单次用药剂量一致,通常选用参比品的最高给药剂量进行试验。
(三)其他注意事项
有关生物样品采集、样品分析方法的建立与确证、数据处理与统计分析、结果评价和研究报告内容等按农业部发布的《兽用化学药品生物等效性试验指导原则》执行。
五、临床疗效验证试验要求
不能采用血药浓度法进行生物等效性试验的兽药品种,应进行临床疗效验证试验。要求如下:
(一)发病动物模型
一般使用人工发病动物。无法人工发病的,可使用自然发病动物进行试验。
(二)试验设计
一般采用3个处理的平行设计,即分为参比品组(阳性对照组)、受试品组(试验组)和发病不给药组(阴性对照组)。
(三)其他注意事项
每组动物数量、观察指标、统计分析和结果判断按相关药物类(抗菌药物、抗寄生虫药物)的Ⅱ期临床药效评价试验指导原则有关规定执行。
用于乳房炎防治的药物可按抗菌药物Ⅲ期临床试验指导原则的要求进行临床疗效验证试验。
六、休药期验证试验要求
生物等效性试验反映的是制剂产品中活性药物的吸收过程,不能反映药物代谢及药物/代谢物的消除。虽然两个产品生物等效,也不能直接采用参比品的休药期。因此,用于食品动物的产品还应验证受试品的休药期是否与参比品相同或少于参比品休药期天数。用于宠物的产品不必进行。
对于需要休药期验证品种,注射剂需包含注射部位肌肉休药期验证,用猪或其他动物代替奶牛做比对试验的产品,需增加奶牛弃奶期验证。
休药期验证试验可采用单一时间点法进行,即按照参比品的休药期,设计一个受试品组,设置动物数10头(只),在参比品休药期时间点宰杀全部动物,测定靶组织中残留标示物的残留量。弃奶期验证试验与休药期验证试验相同,可采用单一时间点法进行,设置奶牛20头,按照《兽药残留试验技术规范(试行)》取样,测定牛奶中残留标示物的残留量。
有关生物样品采集、样品分析方法的建立与确证、数据处理与统计分析、结果评价和研究报告内容等按农业部发布的《兽药残留试验技术规范(试行)》执行。
七、在线抽样量说明
受试品应在产品生产线上抽取。抽样量应满足产品质量检验、生物等效性和休药期验证3个试验的用量。
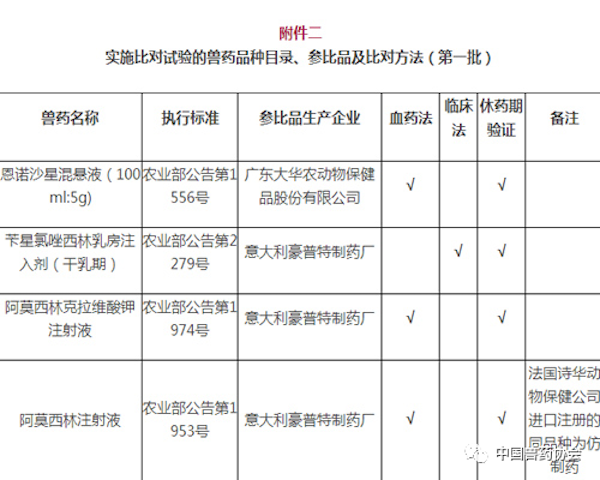
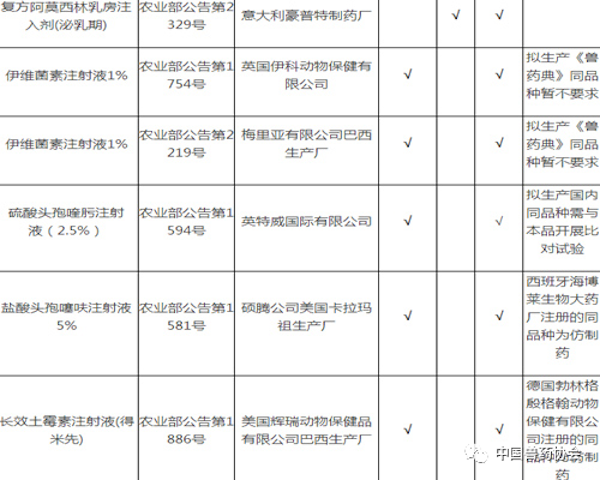
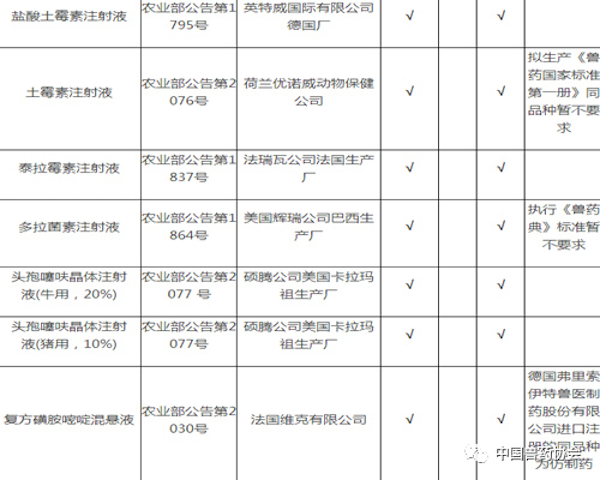
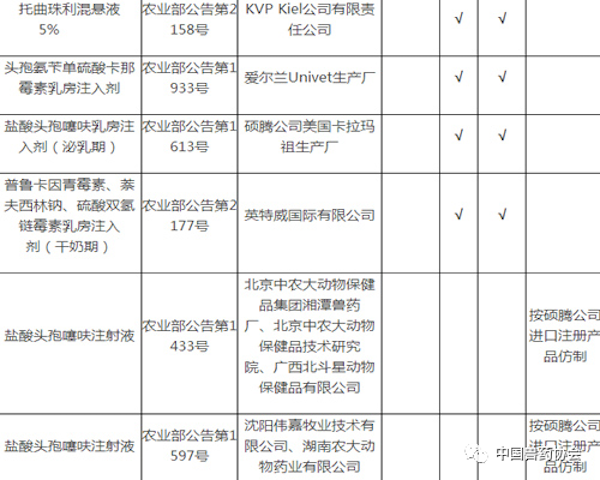
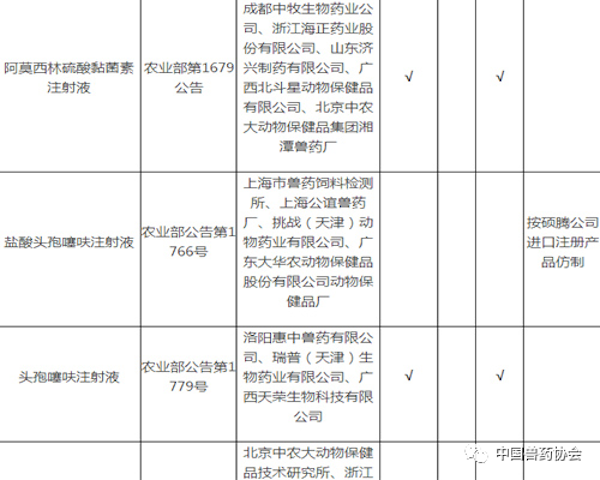
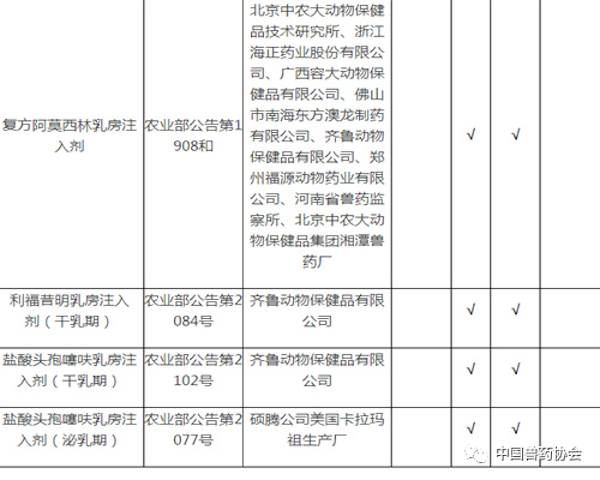
注:
1. 备注栏中标注某公司产品为仿制药的,采用该公司同品种产品开展比对试验的,试验结果无效。
2. 拟生产硫酸头孢喹肟注射液、盐酸头孢噻呋注射液,需与进口注册产品开展比对试验。
3. 拟生产《中国兽药典》或《兽药国家标准第一册》中收载的本目录中同品种产品,暂不要求开展比对试验。
4. 进口兽药再注册后,执行农业部发布的最新进口质量标准。
5. 相应栏中打√的,表示需要开展相应的试验。