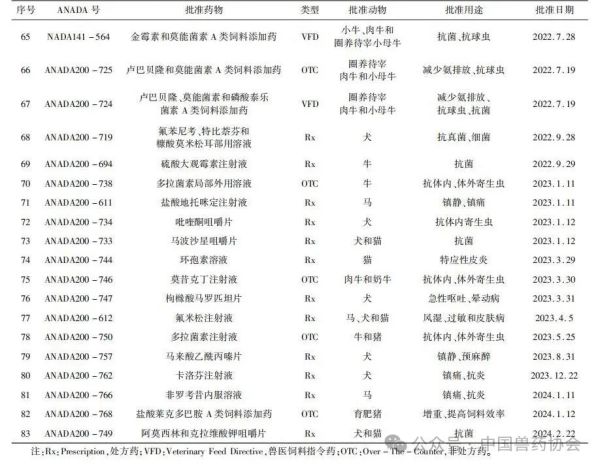
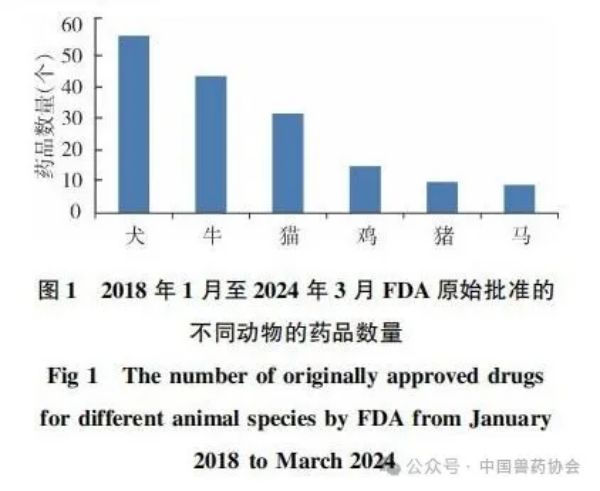
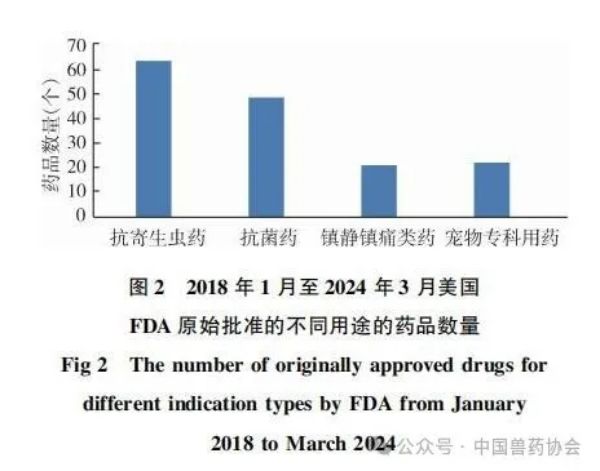
来源:中国兽药协会
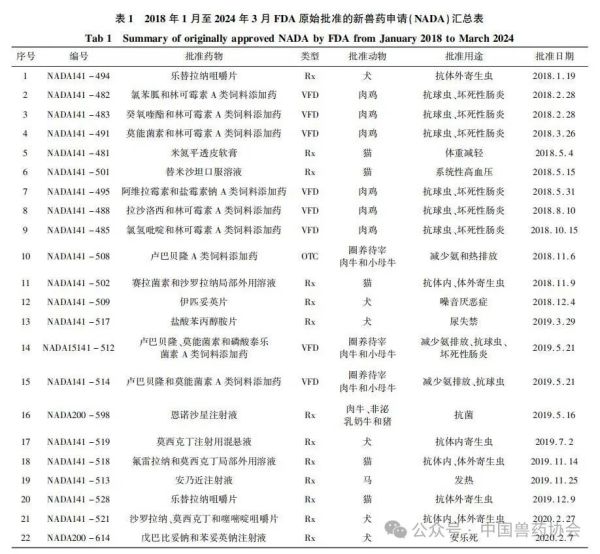
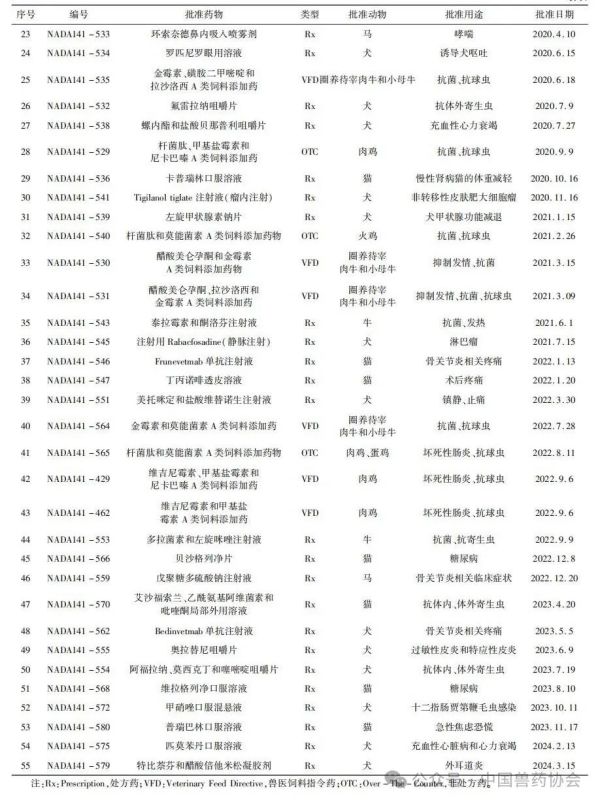
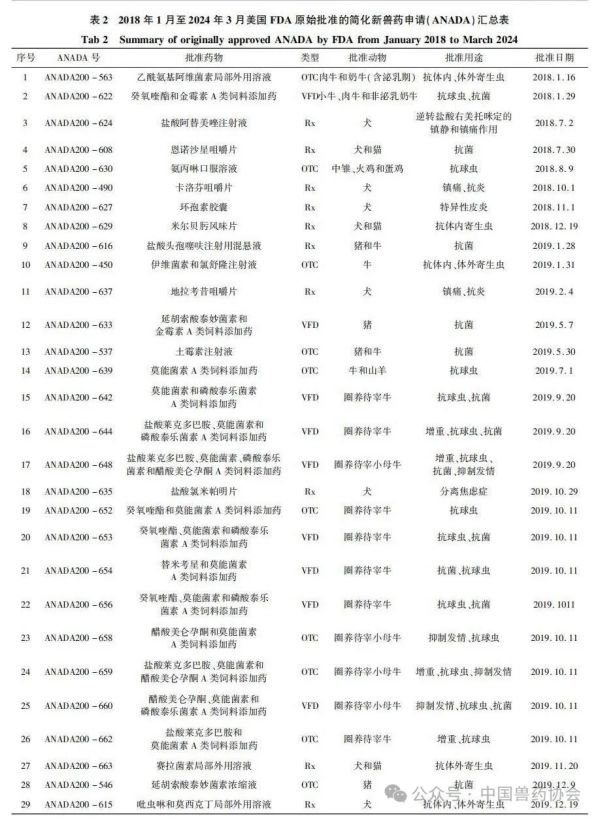
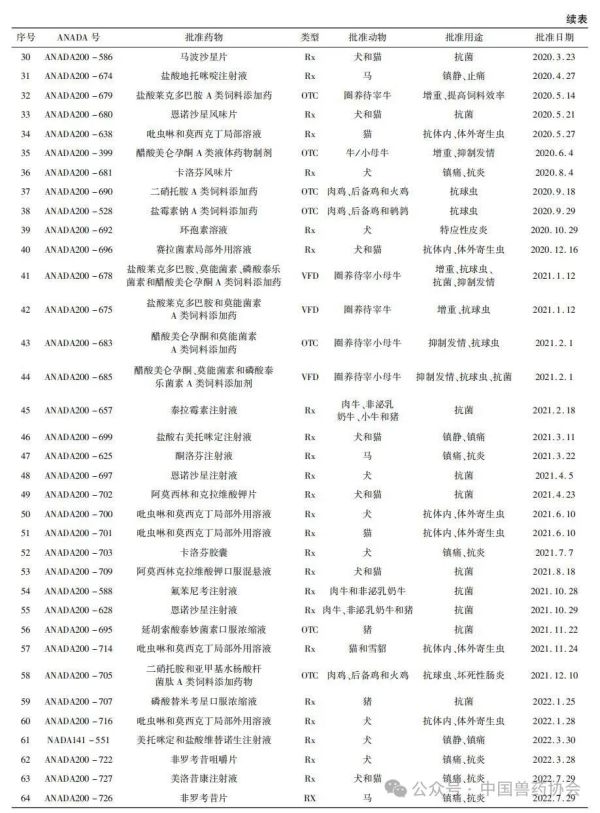
【摘要】介绍了美国FDA兽药上市许可途径,汇总了2018年1月至2024年3月美国FDA原始批准的新兽药申请(NADA)、简化新兽药申请(ANADA)和附条件批准(CA)三种类型的兽药品种,并从批准动物和批准用途等方面进行统计分析,希望能对我国新兽药研发和审评工作有一定的指导意义。
【关键词】美国FDA;兽药;上市许可;新批准兽药;分析
世界各国的兽药管理因国情不同而有所不同,国外主要发达国家的兽药和人用药品一般由统一的机构负责管理。美国的兽药主要由卫生和公众服务部(Department of Health and Human Services,HHS)的食品药品监督管理局(Food and Drug Admin-istration,FDA)进行管理,具体由FDA下设的兽药中心(Center for Veterinary Medicine,CVM)负责。美国的兽用生物制品由农业部(United States Department of Agriculture,USDA)负责管理;兽用麻醉药由毒品管制局(Drug Enforcement Administration,DEA)负责管理;杀虫剂、杀真菌剂、灭鼠剂等由环境保护局(Environmental Protection Agency,EPA)负责管理。 美国兽药管理的相关法规主要有《联邦食品、药品及化妆品法》(Federal Food Drug and Cosmetic Act,FFDCA)和《联邦法典》第21条(Code of Feder-al Regulation21,CFR21)的食品和药品部分。根据FFDCA规定,在美国上市的新兽药都要经过FDA的批准。FDA的新兽药批准过程是开放的,申请人可在研发早期与CVM进行交流,如果申请人有了初步的研发目标药物及其靶动物、适应证,可以向CVM的新兽药评估办公室(Office of New Animal Drug Evaluation,ONADE)进行新兽药临床试验申请(Investigational New Animal Drug,INADA)、讨论新兽药审评所需费用、讨论新兽药研发计划等。美国2003年通过的《兽药申请人付费法案》(Animal Drug User Fee Act,ADUFA)授权CVM可以向申请人收取费用用于兽药审评工作。申请人在INA-DA阶段收集到足够的试验数据和资料来证明兽药的安全性和有效性,并具备新兽药申请条件时,可以向FDA进行新兽药申请,FDA新兽药申请关注的主要技术内容是: ①靶动物安全性; ②有效性; ③人类食品安全; ④化学、生产和控制(Chemistry,Manufacturing and Controls,CMC); ⑤环境影响。 美国FDA兽药上市许可主要通过批准(Ap-proval)、附条件批准(Conditional Approval,CA)、索引(Index)和紧急使用授权(Emergency Use Authori-zation,EUA)四种途径,主要有原始批准(Original Approvals)、补充批准(Supplemental Approvals)、撤回批准(Withdrawal Approvals)、标签变更(Labeling Changes)、申请人变更(Sponsor Changes)、适用性请愿书(Suitability Petitions)等多种方式。 本文重点介绍美国FDA兽药上市许可的四种途径,汇总FDA批准兽药绿皮书(Green Book)中2018年1月至2024年3月这6年多时间内原始批准(Original Approvals)的新兽药申请(New Animal Drug Application,NADA)、简化新兽药申请(Abbre-viated New Animal Drug Application,ANADA)和附条件批准(Conditional Approval,CA)的兽药品种信息,并进行统计分析,希望能对我国新兽药的研发和审评工作有一定的指导意义。 美国FDA兽药上市许可主要有以下四种途径: 1.1批准(Approval) 包括新兽药申请(NADA)和简化新兽药申请(ANADA)。NADA适用于创新化学药物及其产品、新的治疗用途即新的适应证、新的用法用量、新剂型和新复方制剂。ANADA适用于仿制药、专利过期的处方药和已上市非处方药的长效控释制剂。 1.2附条件批准(CA) 适用于某些次要物种使用的兽药或主要物种的次要用途。美国FDA将“次要物种”定义为马、狗、猫、牛、猪、火鸡和鸡七大主要物种之外的动物,包括农业上的绵羊、山羊、鲶鱼和蜜蜂等以及非农业上的动物园动物、观赏鱼、鹦鹉和雪貂等,例如治疗绵羊或山羊疾病的药物就有资格获得附条件批准,因为这两种动物在美国都是次要物种。美国FDA将主要物种的次要用途定义为马、狗、猫、牛、猪、火鸡和鸡七大主要物种每年很少发生或每年在有限地理区域内少量动物发生疾病使用药物治疗的情况,例如一种用于控制犬骨癌疼痛的药物有资格获得附条件批准,因为在美国每年通常不到70,000只犬患骨癌。 附条件批准的兽药按照FDA新兽药申请程序进行了评审,根据标签说明书使用是安全的,并且具有“合理的有效性预期”,但该药物尚未达到完全批准的有效性标准。附条件批准的有效期为1年,之后申请人需每年向FDA提出申请,最多可以再延迟4年。在这5年内,申请人可以合法销售兽药,但必须继续收集有效性数据,提交并通过FDA的评审后该药才可以获得全面批准。 1.3索引(Index) 是《次要物种用未经批准但合法上市的新兽药索引》的简称。索引中的药物未经批准,但可以合法上市,用于某些次要物种的特殊用途,例如非食品动物的次要物种如宠物鸟、宠物仓鼠和观赏鱼、雪貂等,这些动物通常不被人类食用;或者食品动物的次要物种的非食用幼龄阶段,例如牡蛎卵(幼龄牡蛎),由于人们一般不吃牡蛎卵,因此可以对治疗牡蛎卵疾病的药物进行索引,但对治疗人们常吃的成年牡蛎疾病的药物则无法进行索引。 药品进入索引的过程与药品审批过程截然不同,索引在很大程度上依赖于FDA之外的专家组,专家们审查药物在特定次要物种中的安全性以及在预期用途中的有效性,专家组所有专家都必须同意根据标签使用时该药物对受治疗动物的益处大于风险。然后,如果FDA同意专家组的意见,则该药物就可以被添加到索引中。 1.4紧急使用授权(Emergency Use Authorization,EUA) 适用于突发公共卫生事件时所需医疗产品的使用授权。在国家受到包括传染病在内的化学、生物、放射性和核(chemical,biological,radiologicalandnu-clear,CBRN)威胁公共卫生紧急情况下,FDA可以授权未经批准的药品或未经批准使用的已批准药品用于诊断、治疗或预防严重的或威胁生命安全的疾病等。 参考文献:略 通讯作者: 孙雷,中国兽医药品监察所(农业农村部兽药评审中心),正高级兽医师,主要从事兽药残留与食品安全、兽药评审评价等方面工作 。 E-mail : 57469032@ qq. com 来源:《中国兽药杂志》