来源:宠物医师网
瑞喵舒®抗体流调报告:
基于902例猫科动物免疫效价评估
作者:纪亚楠
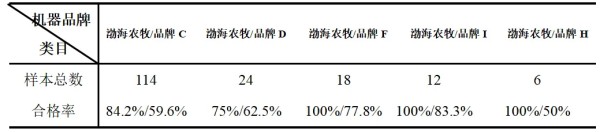
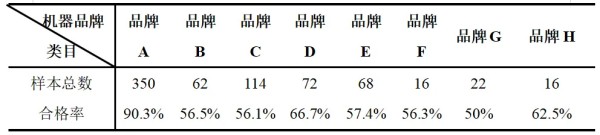
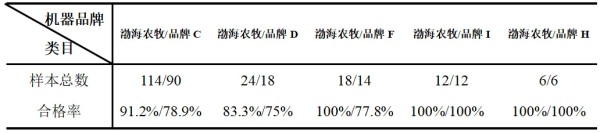
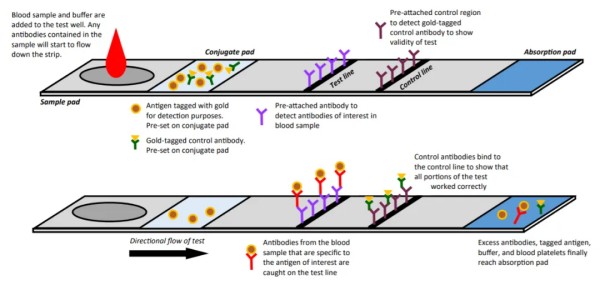
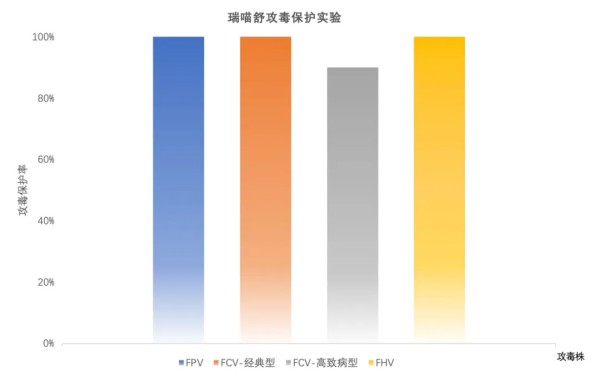
摘要 为了解猫咪初免瑞喵舒后抗体滴度水平及分析临床检测抗体与临床实际保护力的关系,本调查于2024年7月至2025年2月收集全国多个地区多家宠物医院猫咪首免完瑞喵舒后21d的血清样本共计902份,共分两个流调同时进行。 流调一单独使用院内免疫荧光机器检测抗体,共收集728份抗体报告。流调二在临床使用院内免疫荧光机器检测后,同一血清样本送三方实验室检测抗体,共收集174份。对流调一及流调二数据分别进行统计分析。 结果:(1)流调一中猫细小病毒(FPV)合格率为93.4%(680份),疱疹病毒(FHV)合格率63.7%(464份),杯状病毒(FCV)合格率73.1%(532份)。(2)流调二中FPV临床/三方实验室抗体合格率分别为96.6%/100%,FHV临床/三方实验室抗体合格率分别为63.2%(110份)/86.2%(150份),FCV抗体临床/三方实验室抗体合格率分别为80.5%(140份)/92%(160份)。 综合分析表明,瑞喵舒首免完成后对FPV、FHV、FCV三种核心传染病具有良好的临床保护力。 关键词:瑞喵舒,免疫,抗体,保护 1.引言 猫泛白细胞减少症、猫上呼吸道疾病(FURTD)是兽医临床的常见疾病,多由病毒引起,其中主要的病原为猫细小病毒(FPV)、疱疹病毒(FHV)和杯状病毒(FCV),对猫的健康造成威胁,临床上的预防手段以注射疫苗为主。之前疫苗面临的问题主要集中在FHV与FCV临床检测抗体水平较低。有许多因素会造成此种情况出现如疫苗所使用毒株是否为新的流行毒株。三种病毒中FPV与FHV较稳定不易变异,而FCV容易变异[1],且在1998年发现了第一株高致病性毒株FCV-VSD株,可导致具有高死亡率的全身性疾病[2-4]。先前的商品化疫苗对于FCV并不能提供完整的保护,这也导致许多不同的田间毒株的交叉反应有限,在理想情况下,疫苗使用的毒株应适应目前当地所流行传播的田间株[5,6]。一项研究发现,实验猫使用老毒株的疫苗免疫后抗体的中和能力为11.5%(F9)和64.1%(255),而使用新毒株的疫苗免疫后抗体的中和能力为70.5%(G1)和89.7%(431)[7]。因此应对不断变异的FCV及对FCV高致病性毒株具有交叉保护也是临床上对疫苗的新需求。除此之外FPV、FHV、FCV不同病毒主导的免疫方式、临床检测手段、疫苗中所含抗原量的高低也会不同程度的影响临床检测后呈现的抗体水平。 为此,本报告通过对全国免疫瑞喵舒后的临床抗体报告数据、临床抗体报告与三方实验室的抗体报告数据平行对比进行分析以探讨瑞喵舒真实临床保护力及影响临床抗体数据的因素,以期为临床防护猫咪三种核心传染病提供一定的数据参考。 2.材料和方法 2.1材料 2.1.1血清样本 收集来自全国东西南北四个区域共计902份猫的血清样本(见图1),其中东南西北四个区分别收集139份、195份、154份、414份,图1中红色标记点均有血清样本收集,其中以辽宁省、山东省、河南省、重庆市、上海市、浙江省、广东省为主。 图1.报告中血清样本采集分布图 2.1.2其他变量 实验过程中共有10个免疫荧光机器品牌参与实验,三方实验室为具有CNAS认证的天津渤海农牧产业联合研究院。不同地区,不同机器、充足的样本量对于瑞喵舒免疫效果的临床分析提供了足够的科学数据支撑。 本实验猫的纳入标准是: (1)体格检查无异常; (2)日龄>56d,体重>1kg; (3)免疫2-3针瑞喵舒; (4)检测抗体时间为最后一次接种疫苗后15-21d。实验中猫咪信息如表1所示。 表1.实验中各变量信息表 2.2研究方案 流调一:全国分为东南西北四个区域同时进行临床抗体结果收集,详细记录猫咪的年龄、品种、性别、体重、免疫情况、机器品牌及抗体报告,收集报告后对报告数据进行分析。 流调二(平行实验):174份血清样本在临床使用免疫荧光机器进行抗体检测后,同一血清样本经冷冻后邮寄渤海农牧产业联合研究院进行复核检测,收集复核数据后与临床数据进行对比分析。 3.结果 3.1FPV抗体结果 临床检测728份血清中,首免2针、3针后取样血清分别为124份与604份。FPV抗体合格率为93.4%,不合格率为6.6%。详细结果见表2: 表2.临床检测FPV抗体结果 平行实验中,首免2针或3针后取样血清共计174份。临床检测抗体与渤海农牧检测抗体的对比结果见表3: 表3.临床检测与渤海农牧FPV抗体对比结果 3.2FHV抗体结果 728份血清中,首免2针、3针后取样血清分别为124份与604份。FHV抗体合格率为63.7%,不合格率为36.3%。详细结果见表4: 表4.临床检测FHV抗体结果 平行实验中,首免2针或3针后取样血清共计174份。临床检测抗体与渤海农牧检测抗体对比结果见表5: 表5.临床检测与渤海农牧FHV抗体对比结果 3.3FCV抗体结果 728份血清中,首免2针、3针后取样血清分别为124份与604份。FCV抗体合格率为73.1%,不合格率为26.9%,详细结果见表6: 表6.临床检测FCV抗体结果 平行实验中,首免2针、3针后取样血清共计174份。临床检测抗体与渤海农牧检测抗体对比结果见表7: 表7.临床检测与三方实验室FCV抗体对比结果 4.讨论 4.1注射疫苗后影响抗体产生的广泛性原因 4.1.1母源抗体干扰 母源抗体(MDA)是母猫通过初乳传递给幼猫的抗体,帮助幼猫仔免疫系统尚未完全发育时抵抗病原体,然而母源抗体也可能干扰疫苗的免疫效果。 母源抗体对疫苗的干扰机制主要有两种: ①中和疫苗抗原,阻止其刺激幼猫的免疫系统; ②抑制B细胞和T细胞的激活,降低疫苗的免疫效果。 Scott,F.W等人研究表明,母源抗体水平高的幼猫接种疫苗后,抗体效价显著低于母源抗体水平低的幼猫[8]; Verena Jakel等人研究表明尽管进行了三次疫苗接种,36.7%的小猫仍未产生血清转换。即使非常低的MDA滴度也明显抑制了主动免疫的发展。大多数小猫在8和12周龄时显示出显著的MDA滴度;在一些动物中,MDA甚至在20周龄时仍被检测到[9]。 4.1.2寄生虫感染 寄生虫感染主要通过以下几种机制影响猫苗的抗体效价: ①抑制宿主的免疫反应,导致抗体产生不足[10]; ②引发慢性炎症干扰疫苗的免疫反应[11]; ③与宿主竞争营养,导致宿主营养不良,进而影响免疫系统功能[12]。除此之外寄生虫也可通过改变肠道菌群进而影响免疫系统功能。 4.1.3Felv和FIV感染 Felv和FIV是两种猫咪免疫缺陷疾病,感染疾病后会显著影响疫苗效价。Felv和FIV会直接破坏免疫细胞(T细胞和B细胞),导致免疫系统功能受损,从而使疫苗诱导的抗体生成不足。FeLV 和 FIV 感染的猫还更容易发生继发感染,从而影响疫苗效力[13]。 4.1.4营养不良 注射疫苗后产生抗体的过程需要依赖B细胞、T细胞及其他免疫细胞。营养不良会减少B细胞的增殖和分化,抑制T细胞的功能,导致免疫细胞的数量和功能下降[14]。另外营养不良还可能导致促炎和抗炎反应失衡,扰乱免疫细胞之间的信号传递[15]。所以营养不良会通过多种途径影响抗体的产生。 4.1.5应激 猫咪处于应激的状态下也会导致猫苗抗体生成不足。Dhabhar,F.S[16],Padgett,D.A[17]等研究表明应激会激活下丘脑-垂体-肾上腺轴(HPA轴),导致皮质醇等应激激素的释放抑制免疫系统的功能,从而影响抗体的产生。Day,M.J[18]等研究表明疫苗接种后,免疫系统需要产生特异性抗体,而应激会削弱这一过程,导致抗体生成不足。此外,应激还会通过改变肠道菌群平衡、导致猫咪食欲下降等方面间接影响抗体的生成。 4.2接种瑞喵舒后抗体结果分析 4.2.1FPV抗体结果分析 临床收集的728份血清中,合格样本680份,FPV不合格样本为48份,其中有27份FHV、FCV抗体一项或两项高(S5/S6),FPV抗体低(S1/S2);17份三项抗体整体偏低(S0/S1)。17份三项抗体整体偏低的猫咪经后续调查其中有5例猫咪偏瘦(BCS为2或3),其余12例中有6例进行疫苗补免,抗体仍未见明显提升,高度怀疑猫咪本身由于4.1中某项或某几项原因造成猫咪本身抗体生成不良。剩余27份中有8份FHV高,13份FCV高,6份FHV与FCV同时增高,但FPV低。这27只猫咪几乎全部来自繁育场或者有流浪史,怀疑在接种前就有FHV和FCV的野毒感染。而FHV在严重感染情况下,病毒会在宿主免疫细胞中进行大量繁殖,攻击中枢免疫器官,导致机体免疫力下降[19]。FCV在严重感染情况下会通过抑制I型干扰素信号通路,影响激活JAK-STAT信号通路从而影响B细胞的激活、增殖和抗体产生 [20]。所以猫咪在自身抗体生成能力弱(4.1中因素导致)或注射前有FHV和FCV野毒感染的情况下会影响自身抗体产生。 4.2.2FHV、FCV临床检测抗体结果分析 4.2.2.1猫疫苗类型及不同类型疫苗引发的免疫反应及检测抗体的方式 猫咪疫苗主要分为弱毒苗和灭活苗。灭活苗主要通过引发体液免疫发挥作用,而细胞免疫反应较弱[21],主要通过外源性抗原呈递途径(MHC- II类分子)激活CD4+T细胞,但总体来说还是以体液免疫为主。 弱毒苗可同时引发细胞免疫和体液免疫。其中细胞免疫(CMI)主要由T细胞介导,其依赖于病原体在细胞内的复制和内源性抗原呈递(MHC-I类分子)激活CD8+T细胞,弱毒苗因是活病毒可以实现以上途径,而灭活苗却无法实现。 体液免疫主要通过产生特异性抗体(IgG、IgM、IgA和IgE)发挥作用,其中IgG是血清中最主要的抗体类型,IgA主要存在于黏膜表面(如呼吸道)能够阻止病毒通过黏膜入侵,在局部免疫中起重要作用。 目前抗体检测方法主要有三种类型:快速诊断检测(临床上所用免疫荧光检测,原理图见图2[22])和病毒中和实验检测(VNT)。免疫荧光检测通常只能给出定性或半定量结果,在临床检测抗体时也只能检测IgG,所以特异性较低。另一种是专业实验室进行的病毒中和实验(VNT,原理图见图3[22]),其是指病毒在活体内或细胞培养中被特异性抗体中和而失去感染性的一种试验,凡是能与病毒结合,并使其失去感染力的抗体称为中和抗体(VNA),VNT因其能定量且特异性高也被认定为检验疫苗临床保护力的金标准方法[23]。 图2.快速诊断检测机理示意图 图3.中和检测机理示意图 4.2.2FHV、FCV与FPV涉及免疫方式及相关抗体差异 猫苗中FPV的抗体只涉及IgG,所以临床机器检测的抗体结果可作为临床保护力的指标。对FCV的保护已显示与病毒中和抗体(VNA)和细胞免疫相关[24]。其中黏膜IgA水平比IgG水平有更强的保护相关性[25]。对FHV的感染,与其他α疱疹病毒感染一样,细胞免疫比体液免疫对临床保护更为重要[26],此外,作为呼吸道病原体,黏膜免疫在保护猫免受FHV感染中更为重要[27]。临床检测只能检测IgG无法测定IgA及VNA,所以在平行实验中临床抗体检测与三方实验室结果差别较大,实验室检测部分结果与瑞喵舒上市阶段所做攻毒保护实验结果(见图4)相一致。由此可见临床检测结果不能等同于中和抗体结果,所以临床检测抗体结果不能完全代表疫苗的临床保护力。 图4.瑞喵舒攻毒保护实验数据图 5.小结 1、瑞喵舒自2024年1月上市以来截止到2025年3月显示批签发总计为一百七十七万头份,临床未发现正常免疫后由疫苗引起的严重不良反应及死亡案例,说明瑞喵舒安全性良好。 2、瑞喵舒首免程序完成后均可很好的预防FPV,且FPV临床抗体检测结果可以作为临床保护力的参考标准,但需要特别注意会影响FPV抗体产生的因素。 3、渤海农牧抗体结果与攻毒保护实验结果相一致,临床也未接到成功接种瑞喵舒后感染FHV、FCV的案例,说明瑞喵舒程序完成后均可很好的预防FHV和FCV,且临床检测抗体结果不能完全代表疫苗的临床保护力。 4、临床免疫过程中可通过多种途径如选择含有本土流行毒株的高抗原疫苗、按照先驱虫后免疫进行规范的免疫程序、无惧操作、不在FHV、FCV急性发作期进行免疫等降低各种因素对抗体生成的影响。 参考文献 1. Baulch-Brown, C.; Love, D.; Meanger, J. Sequence variation within the capsid protein of Australian isolates of feline calicivirus. Vet. Microbiol. 1999, 68, 107–117. [CrossRef] 2. Hurley, K.E.; Pesavento, P.A.; Pedersen, n.C.; Poland, A.M.; Wilson, E.; Foley, J.E. An outbreak of virulent systemic feline calicivirus disease. J. Am. Vet. Med. Assoc. 2004, 224, 241–249. [CrossRef] 3. Coyne, K.P.; Jones, B.R.; Kipar, A.; Chantrey, J.; Porter, C.J.; Barber, P.J.; Dawson, S.; Gaskell, R.M.; Radford, A.D.Lethal outbreak of disease associated with feline calicivirus infection in cats. Vet. Rec. 2006, 158, 544–550. 4. Schulz, B.S.; Hartmann, K.; Unterer, S.; Eichhorn, W.; Majzoub, M.; Homeier-Bachmann, T.; Truyen, U.;Ellenberger, C.; Huebner, J. Two outbreaks of virulent systemic feline calicivirus infection in cats in Germany.Berl. Munch. Tierarztl. Wochenschr. 2011, 124, 186–193. 5. Pedersen, N.C.; Elliott, J.B.; Glasgow, A.; Poland, A.; Keel, K. An isolated epizootic of hemorrhagic-like fever in cats caused by a novel and highly virulent strain of feline calicivirus. Vet. Microbiol. 2000, 73, 281–300.[CrossRef] 6. Lauritzen, A.; Jarrett, O.; Sabara, M. Serological analysis of feline calicivirus isolates from the United States and United Kingdom. Vet. Microbiol. 1997, 56, 55–63. [CrossRef] [PubMed] 7. Wensman, J.J.; Samman, A.; Lindhe, A.; Thibault, J.C.; Berndtsson, L.T.; Hosie, M.J. Ability of vaccine strain induced antibodies to neutralize field isolates of caliciviruses from Swedish cats. Acta. Vet. Scand. 2015, 57,86. [CrossRef] 8.Scott, F. W., & Geissinger, C. M. (1999). Long-term immunity in cats vaccinated with an inactivated trivalent vaccine. *American Journal of Veterinary Research*, 60(5), 652-658. 9. Verena Jakel1*†, Klaus Cussler1, Kay M Hanschmann1, Uwe Truyen2, Matthias König3†, Elisabeth Kamphuis1 and Karin Duchow. Vaccination against Feline Panleukopenia:implications from a field study in kittens. Jakel et al. BMC Veterinary Research 2012, 8:62 10. Motran CC, Silvane L, Chiapello LS,Theumer MG, Ambrosio LF, Volpini X,Celias DP and Cervi L.Helminth Infections: Recognition and Modulation of the Immune Response by Innate Immune Cells. Frontiers in Immunology.2018 11. Maizels, R. M., & McSorley, H. J. (2016). Regulation of the host immune system by helminth parasites.Journal of Allergy and Clinical Immunology, 138(3), 666-675. 12. Coop, R. L., & Holmes, P. H. (1996).Veterinary Parasitology. 13. Hartmann, K. (2012). Clinical aspects of feline retroviruses: A review.Viruses, 4(11), 2684-2710. 14. Chandra, R. K. (1997). Nutrition and the immune system: an introduction.The American Journal of Clinical Nutrition, 66(2), 460S-463S. 15. Calder, P. C. (2013). Feeding the immune system.Proceedings of the Nutrition Society, 72(3), 299-309. 16.Dhabhar, F. S. (2014). Effects of stress on immune function: the good, the bad, and the beautiful. *Immunologic Research*, 58(2-3), 193-210. 17.Padgett, D. A., & Glaser, R. (2003). How stress influences the immune response. *Trends in Immunology*, 24(8), 444-448. 18.Day, M. J. (2006). Vaccine side effects: fact and fiction. *Veterinary Microbiology*, 117(1), 51-58. 19. Thiry, E.; Addie, D.; Belak, S.; Boucraut-Baralon, C.; Egberink, H.; Frymus, T.; Gruffydd-Jones, T.; Hartmann, K.; Hosie, M.J.;Lloret, A.; et al. Feline herpesvirus infection. ABCD guidelines on prevention and management. J. Feline Med. Surg. 2009, 11,547–555. [CrossRef] [PubMed] 20. Tian J, Kang H, Huang J, Li Z, Pan Y, Li Y, et al. (2020) Feline calicivirus strain 2280 p30 antagonizes type I interferon-mediated antiviral innate immunity through directly degrading IFNAR1 mRNA. PLoS Pathog 16(10): e1008944. 21. 余紫葳,刘永相,范春艳,檀子卿. 猫疱疹病毒研究进展.动物医学进展 2024.06 22. Serology-based tests for COVID-19.Retrieved April 20,2020. https://www.centerforhealthsecurity.org/resources/COVID-19/serology/Serology-based-tests-for-COVID-19.html 23. Tian J, Kang H, Huang J, Li Z, Pan Y, Li Y, et al. (2020) Feline calicivirus strain 2280 p30 antagonizes type I interferon-mediated antiviral innate immunity through directly degrading IFNAR1 mRNA. PLoS Pathog 16(10): e1008944. 24. Amanna, I. J., & Slifka, M. K. (2011).Contributions of humoral and cellular immunity to vaccine-induced protection in humans. Virology, 411(2), 206-215. 25. Egberink, H.; Frymus, T.;Hartmann, K.; Möstl, K.; Addie, D.D.;Belák, S.; Boucraut-Baralon, C.;Hofmann-Lehmann, R.; Lloret, A.;Marsilio, F.; et al. Vaccination and Antibody Testing in Cats. Viruses2022, 14, 1602. 26. Tham, K.M.; Studdert, M.J. Antibody and cell-mediated immune responses to feline calicivirus following inactivated vaccine and challenge. Zent. Vet. B 1987, 34, 640–654. [CrossRef] 27. Sato, H.; Sehata, G.; Okada, N.; Iwamoto, K.; Masubuchi, K.; Kainuma, R.; Noda, T.; Igarashi, T.; Sawada, T.; Noro, T.; et al.Intranasal immunization with inactivated feline calicivirus particles confers robust protection against homologous virus and suppression against heterologous virus in cats. J. Gen. Virol. 2017, 98, 1730–1738. [CrossRef]